题目内容
17.关于如图装置的说法正确的是( )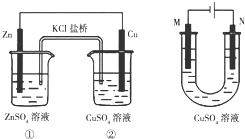
| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
分析 A、原电池是将化学能转化为电能;
B、原电池中阴离子移向负极;
C、电镀时,镀件作阴极;
D、电解精炼铜时,阳极上比铜活泼的金属也放电,阴极上只有铜离子放电.
解答 解:A、原电池是将化学能转化为电能,故A错误;
B、Zn比铜活泼为负极,Cu为正极,Cl-移向负极ZnSO4溶液,故B正确;
C、用装置②用于铁棒镀铜,则N极为铜棒,故C错误;
D、电解精炼铜时溶液中的Cu2+浓度减小,故D错误;
故选B.
点评 本题考查了原电池和电解的相关知识、原理,题目难度不大,注意电极反应类型和离子移动方向.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
7.把两份质量均是m g的铝粉,分别投到盛有100mL的浓度均为1.0mol/L的盐酸和氢氧化钠溶液的两烧杯中,充分反应后,则下列说法中不正确的是( )
| A. | 若两烧杯中铝粉均已完全溶解,则两烧杯中放出氢气的量相同 | |
| B. | 若两烧杯中铝粉均未完全溶解,则盛氢氧化钠溶液的烧杯中放出氢气的量更多 | |
| C. | 若反应后,有一个烧杯中铝粉完全溶解,另一个烧杯中铝粉没有完全溶解,则那个还有铝没有溶解的烧杯原来盛着的是氢氧化钠溶液 | |
| D. | 无论如何,盐酸与铝粉反应产生的H2不可能比氢氧化钠溶液与铝粉反应产生的H2多 |
8.下列化学式可称为分子式的是( )
| A. | NaNO3 | B. | Mg | C. | SO3 | D. | SiO2 |
2.次氯酸可用于杀菌消毒.已知25°C时:
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l);△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l);△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | PH=3的HClO溶液,加水稀释后,溶液中所有的离子浓度降低 | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq);△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
9.下列说法错误的是( )
| A. | 分类是研究物质性质的一种重要方法 | |
| B. | 许多化学定律的提出是建立在实验事实和逻辑推理基础上的 | |
| C. | 假说最终都可以变成科学理论 | |
| D. | 化学基本原理的应用是有一定条件的 |
 草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O
草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O