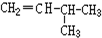题目内容
7.用铂作电极电解相同浓度的盐酸和硫酸,一段时间后,下列说法正确的是( )| A. | 盐酸和硫酸的浓度都增大 | B. | 盐酸和硫酸的浓度都减大 | ||
| C. | 盐酸的浓度减小,硫酸的浓度增大 | D. | 盐酸的浓度增大,硫酸的浓度减小 |
分析 用铂作电极电解相同浓度的盐酸和硫酸,其电池反应式分别为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,所以电解稀盐酸时是电解HCl,电解稀硫酸时相当于电解水,据此分析解答.
解答 解:用铂作电极电解相同浓度的盐酸和硫酸,其电池反应式分别为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,所以电解稀盐酸时是电解HCl,电解稀硫酸时相当于电解水,则电解一段时间后,稀盐酸中溶质变少、稀硫酸中溶质物质的量不变而溶液体积减小,所以盐酸浓度减小、硫酸浓度增大,故选C.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及溶液中溶质或溶剂物质的量变化是解本题关键,熟练掌握阴阳离子放电顺序,题目难度不大.

练习册系列答案
相关题目
18.下列化合物中,含有离子键的是( )
| A. | CO2 | B. | HCl | C. | NH3 | D. | NaCl |
15.在15.2g铁和铜的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列X的组成合理的是( )
| A. | 0.3molNO2、0.1molNO | B. | 0.6molNO | ||
| C. | 0.3molNO、0.1molNO2 | D. | 0.2molNO2、0.2molNO |
2.下列电离方程式正确的是( )
| A. | Na2SO4═Na++SO4-2 | B. | BaCl2═Ba2++Cl2- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | K2S═2K+S |
9.用惰性电极电解下列各溶液,经一段时间后,溶液的浓度增大,而溶液pH值保持不变的是( )
| A. | CuCl2溶液 | B. | KCl溶液 | C. | H2SO4溶液 | D. | K2SO4溶液 |
6.下列物质既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①Al2O3 ②Al(OH)3 ③Al.
①Al2O3 ②Al(OH)3 ③Al.
| A. | ①②③ | B. | ①和③ | C. | ②和③ | D. | ①和② |
7.下列有机反应属于同一反应类型的是( )
| A. | 乙烯使溴的四氯化碳溶液褪色;苯使溴水褪色 | |
| B. | 由苯制环己烷;乙酸制乙酸乙酯 | |
| C. | 苯制溴苯;由乙烯制乙醇 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色;乙醇与灼热的氧化铜反应 |
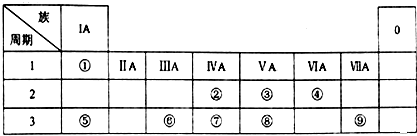
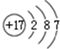 .
.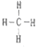 ⑧的最高价氧化物的水化物的分子式H3PO4.
⑧的最高价氧化物的水化物的分子式H3PO4. .
. 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.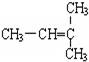 和
和