题目内容
实验室要用98%(ρ=1.84g?cm-3)的硫酸配制3.68mol?L-1的硫酸溶液400mL
(1)计算所需98%的硫酸 mL
(2)该实验中除了要用到量筒、烧杯以外,还需要用到的玻璃仪器(无需装瓶)有: 、 、 .
(3)若配制3.68mol?L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将导致所配制的硫酸溶液浓度偏低的是 .
A、浓硫酸溶解后未冷却,直接转移至容量瓶后定容
B、将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外
C、用量筒量取浓硫酸时,俯视读数
D、容量瓶使用前用3.68mol?L-1硫酸的溶液润洗.
(1)计算所需98%的硫酸
(2)该实验中除了要用到量筒、烧杯以外,还需要用到的玻璃仪器(无需装瓶)有:
(3)若配制3.68mol?L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将导致所配制的硫酸溶液浓度偏低的是
A、浓硫酸溶解后未冷却,直接转移至容量瓶后定容
B、将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外
C、用量筒量取浓硫酸时,俯视读数
D、容量瓶使用前用3.68mol?L-1硫酸的溶液润洗.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)先根据C=
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,根据浓硫酸的体积选取量筒规格;
(2)根据各仪器的作用选取仪器;
(3)根据C=
判断,如果n偏小或V偏大,则配制溶液浓度偏低.
| 1000ρw |
| M |
(2)根据各仪器的作用选取仪器;
(3)根据C=
| n |
| V |
解答:
解:(1)由于实验室中无400mL容量瓶,故选取容量瓶体积应为500mL,故稀释后溶液的体积为500mL,即0.5L,浓硫酸的浓度:C=
=
mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=3.68mol/L×0.5L,V=0.1L=100mL,故答案为:100;
(2)需要的仪器有:用于稀释浓硫酸的烧杯、量取仪器量筒、配制溶液的500mL容量瓶、定容用的胶头滴管、引流和搅拌使用的玻璃棒,
故答案为:玻璃棒;胶头滴管;500mL容量瓶;
(3)A、浓硫酸溶解后未冷却,直接转移至容量瓶后定容,溶液冷却后,体积减小,故导致浓度偏大;
B、将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外,致使浓硫酸的物质的量减小,故所配溶液浓度偏小;
C、用量筒量取浓硫酸时,俯视读数,导致浓硫酸的物质的量偏小,故浓度偏小;
D、容量瓶使用前用3.68mol?L-1硫酸的溶液润洗,导容量瓶内浓硫酸物质的量增大,故浓度偏高,
故选BC.
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
(2)需要的仪器有:用于稀释浓硫酸的烧杯、量取仪器量筒、配制溶液的500mL容量瓶、定容用的胶头滴管、引流和搅拌使用的玻璃棒,
故答案为:玻璃棒;胶头滴管;500mL容量瓶;
(3)A、浓硫酸溶解后未冷却,直接转移至容量瓶后定容,溶液冷却后,体积减小,故导致浓度偏大;
B、将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外,致使浓硫酸的物质的量减小,故所配溶液浓度偏小;
C、用量筒量取浓硫酸时,俯视读数,导致浓硫酸的物质的量偏小,故浓度偏小;
D、容量瓶使用前用3.68mol?L-1硫酸的溶液润洗,导容量瓶内浓硫酸物质的量增大,故浓度偏高,
故选BC.
点评:本题考查一定物质的量浓度溶液的配制,误差分析等,注意容量瓶的选取方法,为易错点.

练习册系列答案
相关题目
密闭容器中进行的反应2SO2+O2?2SO3温度保持不变,下列说法中正确的是( )
| A、增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 |
| B、增加O2的浓度,正反应速率逐渐增大 |
| C、增加SO2的浓度,平衡常数增大 |
| D、若平衡时SO2的浓度比原来大,则平衡常数增大 |
可用分液漏斗分离的一组液体混合物是( )
| A、溴和苯 | B、甘油和水 |
| C、水和溴乙烷 | D、乙醇和汽油 |
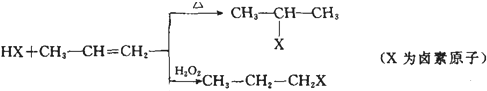
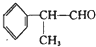
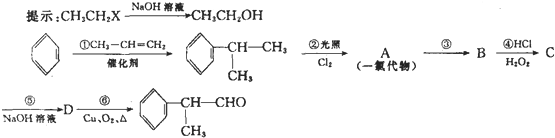
 氨气主要用作致冷剂及制取铵盐和氨肥
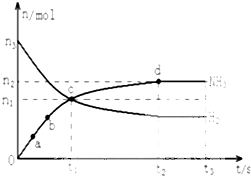
氨气主要用作致冷剂及制取铵盐和氨肥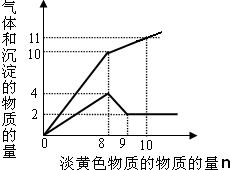 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是



