题目内容
(1)有A、B、C、D四种金属.将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出.据此,判断它们的活动性由强到弱的顺序是
(2)下列如图1装置可防止铁棒被腐蚀的是
(3)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图2所示装置中,过一段时间观察,导管中的水柱会上升,说明发生的是 (填“吸氧腐蚀”或“析氢腐蚀”).写出相关的电极反应式:负极 ,正极
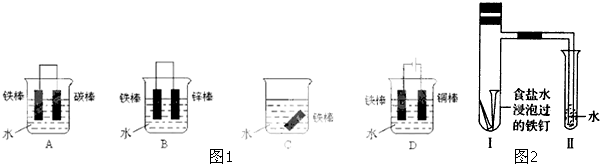
(2)下列如图1装置可防止铁棒被腐蚀的是
(3)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图2所示装置中,过一段时间观察,导管中的水柱会上升,说明发生的是

考点:金属的电化学腐蚀与防护,原电池和电解池的工作原理
专题:电化学专题
分析:(1)原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属.
(2)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(3)铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.
(2)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(3)铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.
解答:
解:(1)两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B;
金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C,所以金属的活动性顺序为:D>A>B>C,
故答案为:D>A>B>C;
(2)装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,故答案为:BD;
(3)铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.试管中铁钉发生反应电极反应式分别为:负极 Fe-2e-═Fe 2+,正极 O2+2H2O+4e-═4OH-,金属发生吸氧腐蚀,生铁遇到氯化钠溶液发生吸氧腐蚀,导致I试管中气体压强减小,小于大气压,所以II试管中的导管内水柱上升.
故答案为:吸氧腐蚀;Fe-2e-═Fe 2+;O2+2H2O+4e-═4OH-.
金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C,所以金属的活动性顺序为:D>A>B>C,
故答案为:D>A>B>C;
(2)装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,故答案为:BD;
(3)铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.试管中铁钉发生反应电极反应式分别为:负极 Fe-2e-═Fe 2+,正极 O2+2H2O+4e-═4OH-,金属发生吸氧腐蚀,生铁遇到氯化钠溶液发生吸氧腐蚀,导致I试管中气体压强减小,小于大气压,所以II试管中的导管内水柱上升.
故答案为:吸氧腐蚀;Fe-2e-═Fe 2+;O2+2H2O+4e-═4OH-.
点评:本题考查了金属活动性强弱的判断、金属腐蚀的原理以及原电池的工作原理知识,难度不大,能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱.

练习册系列答案
相关题目
常温下,有下列四种溶液:①0.1mol/L NaOH溶液 ②pH=11的NaOH溶液 ③0.1mol/L CH3COOH溶液 ④pH=3的CH3COOH溶液,下列说法正确的是( )
| A、由水电离出的c(H+):①>③ |
| B、③稀释到原来的100倍后,pH与④相同 |
| C、①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) |
| D、②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
在常温下,不能说明醋酸是弱电解质的是( )
| A、测得0.1mol?L-1醋酸溶液pH大于1 |
| B、相同条件下醋酸与盐酸相比,醋酸导电性弱 |
| C、醋酸溶液的pH比盐酸的pH大 |
| D、等体积相同pH盐酸和醋酸与同浓度NaOH溶液完全反应,醋酸所需NaOH溶液的体积大 |
加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该固体物质的是( )
| A、氯化铝 | B、碳酸氢镁 |
| C、碳酸钠 | D、高锰酸钾 |
下列说法正确的是( )
| A、熵增大的反应一定是自发反应 |
| B、焓增大的反应一定是自发反应 |
| C、熵、焓都为正值的反应一定是自发反应 |
| D、△H-T△S<0 的反应一定是自发反应 |
已知一些物质的标准燃烧热:等质量的下列物质充分燃烧放出热量最多的是( )
| 燃 料 | H2 | CH4 | C2H2 | C2H5OH |
| 燃烧热△H/kJ.mol-1 | -285.8 | -890.3 | -1299.6 | -1366.8 |
| A、H2B |
| B、CH4 |
| C、C2H2 |
| D、C2H5OH |

