题目内容
 氨气主要用作致冷剂及制取铵盐和氨肥
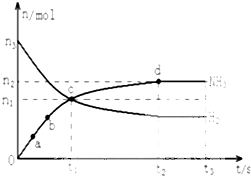
氨气主要用作致冷剂及制取铵盐和氨肥(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673K升至773K,
则n(H2)将增大
D.t2、t3时刻,n(N2)不相等
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率
(3)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
考点:化学平衡的影响因素,热化学方程式
专题:
分析:(1)A、氨气的物质的量越小,反应物的物质的量越大,反应物浓度越大正反应速率越快.
B、c点以后氨气、氢气的物质的量发生变化.
C、升高温度平衡向吸热方向移动.
D、t2、t3时刻,可逆反应处于平衡状态.
(2)利用三段式计算出各物质的浓度变化、平衡时各物质的浓度.
①根据v=
计算v(H2).
②平衡常数k=
,将平衡浓度代入计算.
(3)由已知热化学方程式根据盖斯定律构造目标热化学方程式.
B、c点以后氨气、氢气的物质的量发生变化.
C、升高温度平衡向吸热方向移动.
D、t2、t3时刻,可逆反应处于平衡状态.
(2)利用三段式计算出各物质的浓度变化、平衡时各物质的浓度.
①根据v=
| △c |
| △t |
②平衡常数k=
| c2(NH3) |
| c(N2)?c3(H2) |
(3)由已知热化学方程式根据盖斯定律构造目标热化学方程式.
解答:
解:(1)A、由图可知氨气在点a比在点b时的物质的量小,故a点时反应物的浓度大,反应物浓度越大正反应速率越快,故点a的正反应速率比点b的大,故A正确;
B、由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,故B错误;
C、合成氨正反应是放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,则n(H2)增大,故C正确;
D、t2、t3时刻,可逆反应处于相同平衡状态,n(N2)相等,故D错误;
故选:AC;
(2)等于可逆反应:N2(g)+3H2(g)?2NH3(g)
起始物质的量浓度(mol/L) 0.6 1.6 0
转化物质的量浓度(mol/L) 0.2 0.6 0.4
平衡物质的量浓度(mol/L) 0.4 1 0.4
①3min内以H2表示的化学反应速率v(H2)=
=0.2mol/(L?min),
故答案为0.2mol/(L?min);②平衡常数k=
=
=0.4L2/mol2,
故答案为:0.4L2/mol2;
(3)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
B、由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,故B错误;
C、合成氨正反应是放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,则n(H2)增大,故C正确;
D、t2、t3时刻,可逆反应处于相同平衡状态,n(N2)相等,故D错误;
故选:AC;
(2)等于可逆反应:N2(g)+3H2(g)?2NH3(g)
起始物质的量浓度(mol/L) 0.6 1.6 0
转化物质的量浓度(mol/L) 0.2 0.6 0.4
平衡物质的量浓度(mol/L) 0.4 1 0.4
①3min内以H2表示的化学反应速率v(H2)=
| 0.6mol/L |
| 3min |
故答案为0.2mol/(L?min);②平衡常数k=
| c2(NH3) |
| c(N2)?c3(H2) |
| (0.4mol/L)2 |
| 0.4mol/L?(1mol/L)3 |
故答案为:0.4L2/mol2;
(3)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
点评:考查热化学方程式书写、影响平衡移动的因素、平衡图象、化学平衡计算等,难度中等,注意掌握三段式解题法与盖斯定律.

练习册系列答案
相关题目
以下实验操作正确的是( )
| A、用量筒量取5.0 mL浓硫酸并直接在量筒中稀释 |
| B、用嘴吹灭燃着的酒精灯火焰 |
| C、称量NaOH固体时,将药品直接放在托盘上 |
| D、给烧瓶里的液体加热时,垫上石棉网 |
在常温下,不能说明醋酸是弱电解质的是( )
| A、测得0.1mol?L-1醋酸溶液pH大于1 |
| B、相同条件下醋酸与盐酸相比,醋酸导电性弱 |
| C、醋酸溶液的pH比盐酸的pH大 |
| D、等体积相同pH盐酸和醋酸与同浓度NaOH溶液完全反应,醋酸所需NaOH溶液的体积大 |
 )化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.
)化合物,如:RCH=CH-OH→R-CH2-CHO.取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜反应而B不能.