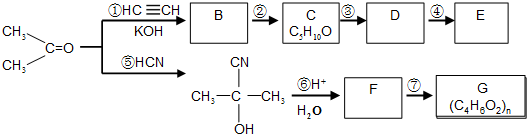
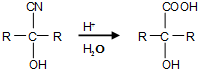
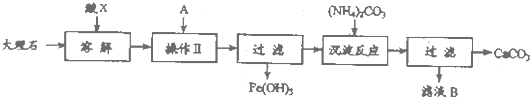
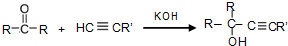��Ŀ����
��һ��������ܱ������У��������·�Ӧ��CO2��g��+H2��g��NOCO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
�ش��������⣺
��1����Ӧ��ѧƽ�ⳣ���ı���ʽ��K= ��
��2���÷�ӦΪ ��ѡ����ȡ����ȡ�����Ӧ��
��3��ij�¶��£������ʵ�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2��=c��CO����c��H2O�������д�ʱ���¶�Ϊ ��
��4����1000�������£���÷�Ӧ��������ĸ����ʵ�Ũ�����±���
���ʱ�̣�v������ v���棩��ѡ����ڡ��������ڡ���С�ڡ���
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1����Ӧ��ѧƽ�ⳣ���ı���ʽ��K=
��2���÷�ӦΪ
��3��ij�¶��£������ʵ�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2��=c��CO����c��H2O�������д�ʱ���¶�Ϊ
��4����1000�������£���÷�Ӧ��������ĸ����ʵ�Ũ�����±���
| ���� | CO2 | H2 | CO | H2O |
| Ũ�ȣ�mol/L�� | 0.1 | 0.9 | 0.3 | 0.3 |
���㣺�û�ѧƽ�ⳣ�����м���,���ȷ�Ӧ�ͷ��ȷ�Ӧ
ר�⣺
��������1�����ݻ�ѧƽ�ⳣ���ĸ�������д��
��2�������¶ȶԻ�ѧƽ�⡢��ѧƽ�ⳣ����Ӱ�����ش�
��3������ƽ�ⳣ����ֵ�����ҳ���Ӧ�¶ȣ�
��4������1000��ʱŨ�Ȼ���ƽ�ⳣ���Ĺ�ϵ��
��2�������¶ȶԻ�ѧƽ�⡢��ѧƽ�ⳣ����Ӱ�����ش�
��3������ƽ�ⳣ����ֵ�����ҳ���Ӧ�¶ȣ�
��4������1000��ʱŨ�Ȼ���ƽ�ⳣ���Ĺ�ϵ��
���
�⣺��1����ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮��������K=
���ʴ�Ϊ��
��
��2����ѧƽ�ⳣ���Ĵ�Сֻ���¶��йأ������¶ȣ�ƽ�������ȵķ����ƶ����ɱ���֪�������¶ȣ���ѧƽ�ⳣ������˵����ѧƽ�������ƶ����������Ӧ�������ȣ�
�ʴ�Ϊ�����ȣ�
��3����3c��CO2��?c��H2��=5c��CO��?c��H2O������֪k=
=0.6����Ӧ�¶�Ϊ700t�棬�ʴ�Ϊ��700��
��4����1000�������£�Q=
=
=1��1.7��ƽ�������ƶ���v��������v���棩���ʴ�Ϊ�����ڣ�
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
��2����ѧƽ�ⳣ���Ĵ�Сֻ���¶��йأ������¶ȣ�ƽ�������ȵķ����ƶ����ɱ���֪�������¶ȣ���ѧƽ�ⳣ������˵����ѧƽ�������ƶ����������Ӧ�������ȣ�
�ʴ�Ϊ�����ȣ�
��3����3c��CO2��?c��H2��=5c��CO��?c��H2O������֪k=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
��4����1000�������£�Q=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| 0.3��0.3 |
| 0.1��0.9 |
���������⿼�黯ѧƽ��ļ��㣬��Ŀ�ѶȲ���ע��ƽ�ⳣ�������úͼ��㣮

��ϰ��ϵ�д�
�����Ŀ
����ʵ��װ�ã��̶�װ����ȥ���Ͳ�����ȷ���ǣ�������
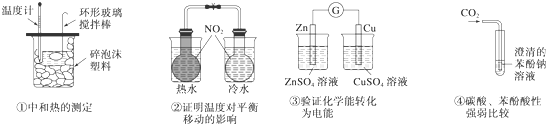

| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
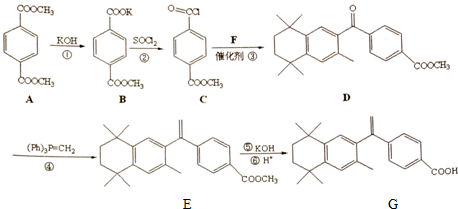
 �����������л�����Ľṹ��ʽΪ
�����������л�����Ľṹ��ʽΪ