题目内容
10.雾霾天气对大气环境、人体健康、交通安全都带来了不利影响,因此引起了人们的高度重视.下列有关雾霾的叙述中不正确的是( )| A. | 霾是一种分散系,分散质是固体 | |
| B. | 雾是一种分散系,分散剂是气体 | |
| C. | 霾属于胶体分散系 | |
| D. | 减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
分析 A.霾分散剂是空气,分散质是空气中的悬浮颗粒物;
B.雾分散剂是空气;
C.霾颗粒较大,不属于胶体分散系;
D.雾霾天气的形成主要来源于扬尘和化石燃料燃烧产生的颗粒物.
解答 解:A.霾分散剂是空气,分散质是空气中的悬浮颗粒物,所以分散质是固体,故A正确;
B.雾分散剂是空气,分散质是水,故B正确;
C.胶体是指分散质粒子直径在1nm-100nm之间的分散系,雾霾不属于气溶胶,它的微粒直径超出了胶体的范围,故C错误;
D.雾霾天气的形成主要来源于化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘,所以减少生产生活中产生的扬尘可以减少雾霾天气的形成,故D正确;
故选C.
点评 本题考查环境污染知识,为高频考点,侧重于化学与环境的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
20.830K时,在恒容密闭容器中进行的可逆反应:C(s)+H2O(g)?H2(g)+CO(g),下列哪种情况下,可说明该反应已经达到化学平衡状态( )
| A. | v正(C):v逆(H2)=1:1的状态 | |
| B. | 用H2O、CO、H2的物质的量浓度变化表示的反应速率的比为1:1:1的状态 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 当平衡常数K不发生改变的时候 |
1.下列物质中含有共价键的离子化合物是( )
| A. | CaCl2 | B. | H2O | C. | HCl | D. | Ba(OH)2 |
18.将下列各组物质按酸、碱、盐分类排序正确的是( )
| A. | 硫酸、纯碱、石灰石 | B. | 硝酸、烧碱、胆矾 | ||
| C. | 醋酸、碱式碳酸铜、醋酸钠 | D. | 盐酸、熟石灰、苛性钠 |
15.某种硬铝合金是由 Al、Cu、Mg三种金属组成,主要应用于耐热可焊的结构件及锻件.某研究小组欲探究该合金的性质并测定合金中铝的质量分数:
(1)甲同学预测:该合金与10mol/L硝酸反应时有NO2气体生成,可能还有NO生成.
查阅资料:常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.设计如下装置进行实验.按图连接装置并检验气密性后,称取5g 合金放于圆底烧瓶中,并滴加10mol/L硝酸.
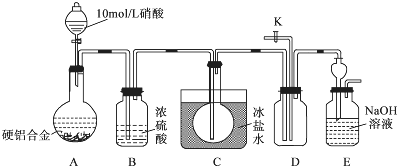
①合金中Cu与稀硝酸反应的离子方程式是3Cu+2NO3-+8H+=Cu2++2NO↑+4H2O.
②C装置的目的是将生成的NO2冷凝为N2O4,与NO分离,排除干扰.
③能证明有NO生成的实验操作与现象是打开活塞K,鼓入空气,若D中的气体由无色变为红棕色,证明有NO生成.
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10mol/L硝酸反应时没有NO生成.乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是在加入HNO3前,通入N2,除尽装置中的空气.
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
pH>7.8时,Al(OH)3开始溶解,pH>10.8时沉淀完全溶解.
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是pH≥12.4.
②选用NaOH溶液调节pH,得到溶液B的离子方程式是Al3++4OH-=AlO2-+2H2O.
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是90%.
(1)甲同学预测:该合金与10mol/L硝酸反应时有NO2气体生成,可能还有NO生成.
查阅资料:常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.设计如下装置进行实验.按图连接装置并检验气密性后,称取5g 合金放于圆底烧瓶中,并滴加10mol/L硝酸.

①合金中Cu与稀硝酸反应的离子方程式是3Cu+2NO3-+8H+=Cu2++2NO↑+4H2O.
②C装置的目的是将生成的NO2冷凝为N2O4,与NO分离,排除干扰.
③能证明有NO生成的实验操作与现象是打开活塞K,鼓入空气,若D中的气体由无色变为红棕色,证明有NO生成.
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10mol/L硝酸反应时没有NO生成.乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是在加入HNO3前,通入N2,除尽装置中的空气.
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是pH≥12.4.
②选用NaOH溶液调节pH,得到溶液B的离子方程式是Al3++4OH-=AlO2-+2H2O.
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是90%.
14.氯气溶于水达到平衡后,若只改变某一条件,下列叙述正确的是( )
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
 如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去). ;
;