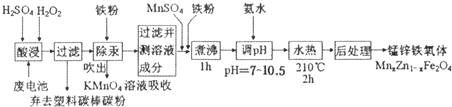
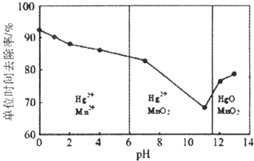
题目内容
10.写出下列的电离方程式:(1)H2SO4:H2SO4=2H++SO42-;
(2)NaOH:NaOH=Na++OH-;
(3)HCl:HCl=H++Cl-.
(4)Na2CO3Na2CO3═2Na++CO32-
(5)Ba (OH)2Ba(OH)2=Ba2++2OH-.
分析 硫酸、氢氧化钠、HCl、碳酸钠、氢氧化钡都属于强电解质,在溶液中完全电离,电离方程式用等号,据此写出5种物质的电离方程式.
解答 解:(1)硫酸为强电解质,在溶液中完全电离,其电离方程式:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)NaOH是强电解质,在水溶液里完全电离生成钠离子、氢氧根离子,其电离方程式为:NaOH=Na++OH-,
故答案为:NaOH=Na++OH-;
(3)HCl为强电解质,在溶液中完全电离出氢离子和氯离子,其电离方程式为:HCl=H++Cl-,
故答案为:HCl=H++Cl-;
(4)碳酸钠为强电解质,在溶液中完全电离出钠离子和碳酸根离子,其电离方程式为:Na2CO3═2Na++CO32-,
故答案为:Na2CO3═2Na++CO32-;
(5)Ba (OH)为强电解质,完全电离,其电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-.
点评 本题考查了电离方程式书写,题目难度不大,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的概念及判断方法,试题侧重基础知识的考查,有利于提高学生的规范答题能力.

练习册系列答案
相关题目
20.下列实验操作中错误的是( )
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
| A. | ②③ | B. | ①③ | C. | ①② | D. | ①④ |
1.将a摩尔H2S与b摩尔SO2气体混合并充分反应,生成c克黄色固体,则下列a、b、c的关系的表达式中一定正确的选项是( )
| A. | 若c=32(a+b),则b=2a | B. | 若c<32(a+b),则a>2b | ||
| C. | 若a<2b,则c=48a | D. | 若a>2b,则32(a+b)>c>96b |
18.下列说法是否正确( )
①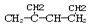 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯
②相对分子质量相同的两种有机物一定是同分异构体
③烯烃各同系物中碳的质量分数都相等
④从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
⑤在相同条件下,燃烧等质量的C2H4和苯,乙烯消耗O2的量多
⑥苯乙炔中最多有6个原子在同一条直线上.
①
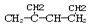 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯②相对分子质量相同的两种有机物一定是同分异构体
③烯烃各同系物中碳的质量分数都相等
④从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
⑤在相同条件下,燃烧等质量的C2H4和苯,乙烯消耗O2的量多
⑥苯乙炔中最多有6个原子在同一条直线上.
| A. | 都不正确 | B. | ③⑤⑥正确 | C. | ②④⑥正确 | D. | ①③⑥正确 |
5.有机物E的名称是( )
| A. | 丁烷 | B. | 2-甲基丙烷 | C. | 1-甲基丙烷 | D. | 甲烷 |
15.二氧化硫的下列性质中,不属于酸性氧化物通性的( )
| A. | SO2+Br2+H2O═H2SO4+2HBr | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2NaOH═Na2SO3+H2O | D. | SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 |
2.铁粉、铜粉混合物样品11.6g,逐步加入2.0mol/L,的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如表:
请回答:
(1)样品中铁与铜的物质的量之比n(Fe):n(Cu)=3:1.
(2)在反应后的体系中,再加入4.0mol/L的H2O2溶液25.0mL,并加入足量硫酸溶液.充分反应后溶液中存在的各金属离子的物质的量分别是多少?
| 硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| 剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
(1)样品中铁与铜的物质的量之比n(Fe):n(Cu)=3:1.
(2)在反应后的体系中,再加入4.0mol/L的H2O2溶液25.0mL,并加入足量硫酸溶液.充分反应后溶液中存在的各金属离子的物质的量分别是多少?
19.据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2═2ZnO;其原料为锌、电解液和空气,则下列叙述不正确的是( )
| A. | 锌为正极 | B. | 电子从锌极流出 | ||
| C. | 锌极发生氧化反应 | D. | 电解液肯定不是强酸 |