题目内容
1.亚氯酸钠(NaClO2)是一种高效漂白剂和强氧化剂.某兴趣小组制取NaClO2的装置如图(B中制得ClO2气体,D中制得NaClO2).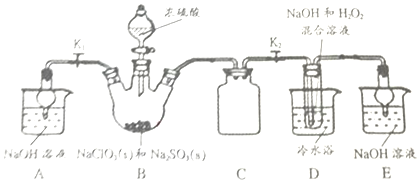
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)实验时B中NaClO2稍微过量,否则会生成SO2.写出B中产生的SO2的化学方程式Na2SO3+H2SO4=Na2SO4+H2O+SO2↑.
(2)装置C的作用是防倒吸.
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意控制硫酸的滴入速度;D中反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;如果撤去D中的冷水浴,可能导致产品中混有的杂志是NaClO3和NaCl.
(4)A、E中NaOH的作用是吸收ClO2尾气,若反应中能够生成了物质的量之比为1:1的两种阴离子,一种为ClO2-,另一种离子为ClO3-.
(5)反应后,经以下步骤可以装置D中的溶液中获得无水NaClO2晶体.将实验操作补充完整.
Ⅰ.55℃蒸发结晶;Ⅱ.趁热过滤;Ⅲ用38-60℃的热水洗涤;Ⅳ,低于60℃干燥,得到成品.
分析 (1)亚硫酸钠过量会与浓硫酸反应生成二氧化硫;
(2)装置C作为安全瓶,可防止液体倒吸;
(3)为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率;NaOH、过氧化氢吸收ClO2,生成ClO2-,根据氧化还原反应规律来书写;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,根据氧化还原反应规律来书写;
(5)NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,故装置D中的溶液中通过55℃蒸发结晶,趁热过滤,用38-60℃的热水洗涤,低于60℃干燥,获得无水NaClO2晶体.
解答 解:(1)实验时B中NaClO3稍微过量,否则过量的亚硫酸钠与浓硫酸反应生成二氧化硫,化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(2)装置C的作用是防倒吸;
故答案为:防倒吸;
(3)为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率,可以控制硫酸的滴入速度,D中为氢氧化钠与过氧化氢、二氧化氯反应生成ClO2-的反应,氯元素化合价从+4价降到+3价,则过氧化氢中的氧元素升价到0为氧气,离子方程式为:2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;如果撤去D中的冷水浴,反应可能得到NaClO3和NaCl;
故答案为:控制硫酸的滴入速度;2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;NaClO3和NaCl;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-;
故答案为:ClO3-;
(5)NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,故装置D中的溶液中通过55℃蒸发结晶,趁热过滤,用38-60℃的热水洗涤,低于60℃干燥,获得无水NaClO2晶体;
故答案为:趁热过滤;用38-60℃的热水洗涤.
点评 本题是一道化工生产过程中的工艺流程,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中.

| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | H2S通入CuSO4溶液中:Cu2++S2-→CuS↓ | |
| C. | FeS固体放人稀盐酸溶液中:FeS+2H+→Fe2++H2S↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O |
| A. | 甲同学准确称取5.0gNaCl配制一定物质的量浓度的溶液时,乙同学发现NaCl固体与砝码放反了,但乙同学认为这个错误操作对实验结果没有影响 | |
| B. | 做酯化反应反应混合液的配制应先加乙醇,再加浓硫酸,冷却后最后加入乙酸 | |
| C. | 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下 | |
| D. | 要检验滴有稀硫酸的蔗糖溶液是否水解,可加入银氨溶液,再水浴加热 |
| A. | 18g重水(D2O)所含的电子数为10NA | |
| B. | 常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA |
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 将铜丝插入足量浓硝酸中:Cu+8H++2NO3-═3Cu2++2NO2↑+H2O | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |
| A. | 2H2+O2 $\stackrel{点燃}{→}$2H2O | B. | 2HCl+Ba(OH)2→2BaCl2+H2O | ||
| C. | H2SO4+Cu(OH)2→CuSO4+2H2O | D. | Ba(OH)2+H2SO4→BaSO4↓+2H2O |
| 城市 | 北京 | 上海 | 天津 | 重庆 | 南京 | 厦门 | 珠海 | 汕头 | 济南 | 杭州 | 成都 |
| 污染指数 | 92 | 72 | 82 | 98 | 95 | 25 | 47 | 54 | 76 | 67 | 87 |
| 首要污染物 | TSP | NOx | TSP | SO2 | TSP | TSP | TSP | TSP | |||
| 空气级别 | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅰ | Ⅰ | Ⅱ | Ⅱ | Ⅱ | Ⅱ |
(1)表各城市中,空气质量最好的是厦门.
(2)酸雨是指pH<5.6的雨水,酸雨的主要成分是亚硫酸、硫酸.表中最容易出现酸雨的城市是重庆.为防止城市出现酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合使用.请写出有关“固硫”反应(不让硫的化合物进入大气)的化学方程式CaO+SO2═CaSO3,2CaSO3+O2═2CaSO4.
(3)汽车尾气中的CO,NO排放也是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个“催化转化器”,使CO与NO反应,生成两种无毒气体,其中之一是N2.写出NO与CO反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,此反应的缺点是在一定程度上提高空气的酸度,其原因是使SO2转化成了SO3.