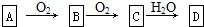题目内容
铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu2+易在酸性条件下发生;2Cu+=Cu2++Cu.大多数+1的价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等.
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为: ,某同学实验时却有黑色物质出现,这黑色物质的化学式为: .
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:a.2Cu2++4I-═2CuI2↓(白色)+I2,b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2,
①若a反应是主要的,需要查询的数据是 .②为顺利观察到白色沉淀可以加入的最佳试剂 .
A.SO2 B.四氯化碳 C.NaOH D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH).
①已知NH5在所有原子都达到稀有气体的稳定结构,请写NH5电子式: .
②写出CuH在过量稀盐酸中有气体生成的离子方程式 .
③将CuH溶解在适量的稀硝酸中,完成下列化学方程式. CuH+ HNO3 Cu(NO3)2+ H2↑+ + .
(4)将实验制得的CuCl样品2.000g(杂质不参与反应)溶于一定量的0.5000mol?L-1FeCl3溶液中,加水稀释至200mL得到溶液,取20.00mL 用0.1000mol?L-1的Ce(SO4)2溶液滴定到终点,消耗20.00mLCe(SO4)2.有关反应式:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则样品中CuCl的质量分数 .
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为:
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:a.2Cu2++4I-═2CuI2↓(白色)+I2,b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2,
①若a反应是主要的,需要查询的数据是
A.SO2 B.四氯化碳 C.NaOH D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH).
①已知NH5在所有原子都达到稀有气体的稳定结构,请写NH5电子式:
②写出CuH在过量稀盐酸中有气体生成的离子方程式
③将CuH溶解在适量的稀硝酸中,完成下列化学方程式.
(4)将实验制得的CuCl样品2.000g(杂质不参与反应)溶于一定量的0.5000mol?L-1FeCl3溶液中,加水稀释至200mL得到溶液,取20.00mL 用0.1000mol?L-1的Ce(SO4)2溶液滴定到终点,消耗20.00mLCe(SO4)2.有关反应式:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则样品中CuCl的质量分数
考点:铜金属及其重要化合物的主要性质,氧化还原反应方程式的配平
专题:氧化还原反应专题,几种重要的金属及其化合物
分析:(1)葡萄糖分子中含有醛基,和新制氢氧化铜浊液加热反应生成砖红色沉淀Cu2O,黑色的物质的产生源于加热温度过高;
(2)通过查询CuI2和CuCl的Ksp可以判断出那种沉淀更难溶,碘水的颜色影响白色沉淀的观察,可以选用萃取剂把碘萃取出来;
(3)①NH5在所有原子都达到稀有气体的稳定结构,说明NH5是由NH4+和H-组成的离子化合物;
②CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,产生的气体为氢气,在酸性溶液中2Cu+=Cu2++Cu.
③Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O;
(4)由两个方程式可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000mol?L-1×0.02L=0.002mol,则2.000g样品中含有n(CuCl)=10×0.002mol=0.02mol,求出质量代入质量分数公式计算.
(2)通过查询CuI2和CuCl的Ksp可以判断出那种沉淀更难溶,碘水的颜色影响白色沉淀的观察,可以选用萃取剂把碘萃取出来;
(3)①NH5在所有原子都达到稀有气体的稳定结构,说明NH5是由NH4+和H-组成的离子化合物;
②CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,产生的气体为氢气,在酸性溶液中2Cu+=Cu2++Cu.
③Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O;
(4)由两个方程式可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000mol?L-1×0.02L=0.002mol,则2.000g样品中含有n(CuCl)=10×0.002mol=0.02mol,求出质量代入质量分数公式计算.
解答:
解:(1)葡糖糖是一个多羟基醛,能与新制氢氧化铜浊液加热反应生成砖红色沉淀Cu2O,如果加热温度过高,氢氧化铜受热分解为黑色的氧化铜和水,
故答案为:砖红色;CuO;
(2)沉淀转移的方向是向着溶解度更小的方向移动,通过查询CuI2和CuCl的Ksp可以判断出那种沉淀更难溶,从而确定那个反应时主要的;碘水是棕褐色的影响白色沉淀的观察,可以用四氯化碳把碘单质萃取出来,由于酒精与水以任意比例混溶,因此不能做萃取剂,
故答案为:Ksp(CuI)和Ksp(CuCl);B;
(3)①NH5在所有原子都达到稀有气体的稳定结构,即氮原子最外层达到8电子稳定结构,所有氢原子达到2电子稳定结构,说明NH5是由NH4+和H-组成的离子化合物,电子式为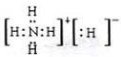 ,
,
故答案为: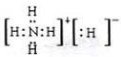 ;
;
②CuH溶解在稀盐酸中,CuH中的H-失电子盐酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑
故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
③Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O,其化学方程式为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
故答案为:6;16;6;3;4;NO;8;H2O;
(4)Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000mol?L-1×0.02L=0.002mol,则2.000g样品中含有
n(CuCl)=10×0.002mol=0.02mol,质量m(CuCl)=0.02mol×99.5g/mol=1.99g,因此样品中CuCl的质量分数=
×100%=99.50%,
故答案为99.50%.
故答案为:砖红色;CuO;
(2)沉淀转移的方向是向着溶解度更小的方向移动,通过查询CuI2和CuCl的Ksp可以判断出那种沉淀更难溶,从而确定那个反应时主要的;碘水是棕褐色的影响白色沉淀的观察,可以用四氯化碳把碘单质萃取出来,由于酒精与水以任意比例混溶,因此不能做萃取剂,
故答案为:Ksp(CuI)和Ksp(CuCl);B;
(3)①NH5在所有原子都达到稀有气体的稳定结构,即氮原子最外层达到8电子稳定结构,所有氢原子达到2电子稳定结构,说明NH5是由NH4+和H-组成的离子化合物,电子式为
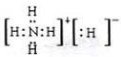 ,
,故答案为:
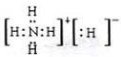 ;
;②CuH溶解在稀盐酸中,CuH中的H-失电子盐酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑
故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
③Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O,其化学方程式为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
故答案为:6;16;6;3;4;NO;8;H2O;
(4)Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000mol?L-1×0.02L=0.002mol,则2.000g样品中含有
n(CuCl)=10×0.002mol=0.02mol,质量m(CuCl)=0.02mol×99.5g/mol=1.99g,因此样品中CuCl的质量分数=
| 1.99g |
| 2.000g |
故答案为99.50%.
点评:本题属于信息给予题,筛选有用信息结合已学知识进行整合处理,涉及萃取剂选取、Ksp意义、硝酸的强氧化性等知识,难度较大.

练习册系列答案
相关题目
对下列常见物质的认识不正确的是( )
| A、明矾可作净水剂 |
| B、CaCO3是陶瓷的主要成分 |
| C、干冰能用作于人工降雨 |
| D、NaHCO3可作抗酸药,能中和胃里过多的酸,缓解胃部不适 |
下列离子方程式书写正确的是( )
| A、Fe与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、CaCO3与CH3COOH溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、Na与H2O反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D、FeCl3溶液与氨水反应:Fe3++3OH-=Fe(OH)3↓ |
下列离子方程式中,正确的是( )
| A、稀盐酸滴入硝酸银溶液中:Ag++Cl-=AgCl↓ |
| B、稀硝酸滴在碳酸钙上:CO32-+2H+=CO2↑+H2O |
| C、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| D、氯气通入氯化亚铁溶液中:Fe2++Cl2=Fe3++2Cl- |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1L0.1mol?L-1的MgCl2溶液中,含有Cl-个数为2NA |
| B、1 molNa2O2与水充分反应转移电子总数为2NA |
| C、常温常压下,NA个NO与NA个N2和O2的混合气体的体积不相等 |
| D、5.4gAl分别与足量的稀硫酸和氢氧化钠反应,失去的电子数都是0.6NA |