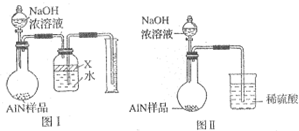
题目内容
为达到表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
试剂及实验方法:
| 实验要求 | 试剂及方法 |
| 鉴别CuSO4、Na2SO4两种粉末 | |
| 检验自来水中是否含有Cl- | |
| 证明Na2CO3溶液具有碱性 | |
| 除去铁粉中混有少量铝粉 |
| A.用试纸测定溶液的pH |
| B.取样,加少量蒸馏水 |
| C.取样,加稀硝酸和硝酸银溶液 |
| D.加过量NaOH溶液后,过滤、洗涤、干燥 |
考点:物质的检验和鉴别的基本方法选择及应用,物质的分离、提纯和除杂
专题:物质检验鉴别题,化学实验基本操作
分析:硫酸钠和硫酸铜溶液的颜色不同;
氯离子能和硝酸酸化的硝酸银反应生成白色沉淀;
碳酸钠为强碱弱酸盐,其溶液呈碱性,常温下pH>7;
铁和强碱不反应,铝能和强碱反应生成可溶性盐,所以可以用强碱溶液除去铁中的铝粉.
氯离子能和硝酸酸化的硝酸银反应生成白色沉淀;
碳酸钠为强碱弱酸盐,其溶液呈碱性,常温下pH>7;
铁和强碱不反应,铝能和强碱反应生成可溶性盐,所以可以用强碱溶液除去铁中的铝粉.
解答:
解:硫酸钠和硫酸铜固体粉末都是白色固体,但硫酸钠溶液为无色、硫酸铜溶液为蓝色,所以可以将两种固体配制成溶液来区分,故选B;
氯离子能和硝酸酸化的硝酸银反应生成白色沉淀,所以要检验自来水中的氯离子可以用硝酸酸化的硝酸银溶液检验,故选C;
碳酸钠为强碱弱酸盐,碳酸根离子水解而导致其溶液呈碱性,常温下碳酸钠溶液的pH>7,所以可以用pH试纸测定溶液的酸碱性判断,故选A;
铁和强碱不反应,铝能和氢氧化钠溶液反应生成可溶性偏铝酸钠,所以可以用氢氧化钠溶液溶解固体,然后再采用过滤的方法分离出铁,故选D.
氯离子能和硝酸酸化的硝酸银反应生成白色沉淀,所以要检验自来水中的氯离子可以用硝酸酸化的硝酸银溶液检验,故选C;
碳酸钠为强碱弱酸盐,碳酸根离子水解而导致其溶液呈碱性,常温下碳酸钠溶液的pH>7,所以可以用pH试纸测定溶液的酸碱性判断,故选A;
铁和强碱不反应,铝能和氢氧化钠溶液反应生成可溶性偏铝酸钠,所以可以用氢氧化钠溶液溶解固体,然后再采用过滤的方法分离出铁,故选D.
点评:本题考查了物质的鉴别、物质的分离和除杂,明确物质的性质是解本题关键,根据物质性质的特殊性来分析解答,知道物质分离的常用方法,离子的检验是高考热点,会运用化学语言描述实验现象,难度中等.

练习册系列答案
相关题目
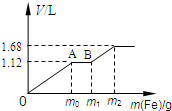 向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )| A、产生氢气的体积为1.68L |
| B、产生二氧化氮的体积为1.12L |
| C、参加反应铁粉的总质量m2=5.6g |
| D、原混合溶液中c(HNO3)=0.5 mol?L-1 |
下列过程中需要吸收热量的是( )
| A、H2→2H |
| B、2H2+O2═2H20 |
| C、CaO+H20=Ca(OH)2 |
| D、2Cl→Cl2 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1mol H2O所含有的原子数为NA |
| B、常温常压下,32g O2含有的氧原子数为2NA |
| C、常温常压下,11.2L Cl2所含的分子数为0.5NA |
| D、1L 0.1mol/L Na2SO4溶液中所含的Na+为0.1NA |
对于可逆反应CO2(g)+NO(g)?CO(g)+NO2(g)(正反应为吸热反应),达到平衡后,改变下列条件,可以使平衡向着正反应方向移动的是( )
| A、降低温度 | B、升高温度 |
| C、减小压强 | D、加入催化剂 |
短周期元素X、Y、Z、W的原子序数依次增大,且最外层电子数之和为12.X与Z同主族,X与Y分属不同周期,Y原予的最外层电子数是电子层数的3倍,W原子的最外层电子数是次外层电子数的一半.下列说法中正确的是( )
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:Y<W |
| C、X与Y只能形成一种化合物 |
| D、Z2WY3可用来制备木材防火剂 |