题目内容
下列离子方程式中,正确的是( )
| A、稀盐酸滴入硝酸银溶液中:Ag++Cl-=AgCl↓ |
| B、稀硝酸滴在碳酸钙上:CO32-+2H+=CO2↑+H2O |
| C、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| D、氯气通入氯化亚铁溶液中:Fe2++Cl2=Fe3++2Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成AgCl和硝酸;
B.碳酸钙在离子反应中保留化学式;
C.Cu与稀硫酸不反应;
D.电子、电荷不守恒.
B.碳酸钙在离子反应中保留化学式;
C.Cu与稀硫酸不反应;
D.电子、电荷不守恒.
解答:
解:A.稀盐酸滴入硝酸银溶液中的离子反应为Ag++Cl-=AgCl↓,故A正确;
B.稀硝酸滴在碳酸钙上的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.Cu与稀硫酸不反应,不能写离子反应,故C错误;
D.氯气通入氯化亚铁溶液中的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选A.
B.稀硝酸滴在碳酸钙上的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.Cu与稀硫酸不反应,不能写离子反应,故C错误;
D.氯气通入氯化亚铁溶液中的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应为解答的关键,注意离子反应的书写方法及物质性质,侧重氧化还原与复分解反应的考查,把握电子、电荷守恒及反应的实质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1mol H2O所含有的原子数为NA |
| B、常温常压下,32g O2含有的氧原子数为2NA |
| C、常温常压下,11.2L Cl2所含的分子数为0.5NA |
| D、1L 0.1mol/L Na2SO4溶液中所含的Na+为0.1NA |
锌粒与稀盐酸反应时,下列因素不会影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、用同质量锌粉替换锌粒 |
| C、溶液的温度 |
| D、加少量硫酸钠 |
对于可逆反应CO2(g)+NO(g)?CO(g)+NO2(g)(正反应为吸热反应),达到平衡后,改变下列条件,可以使平衡向着正反应方向移动的是( )
| A、降低温度 | B、升高温度 |
| C、减小压强 | D、加入催化剂 |
某溶液中存在大量的Al3+、H+、SO42-,则该溶液中还可能大量存在的离子是( )
| A、OH- |
| B、Ba2+ |
| C、NH4+ |
| D、CO32- |
在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是( )
| A、NH4+ |
| B、Al3+ |
| C、Ca2+ |
| D、SO42- |
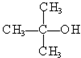 ③
③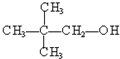 ④
④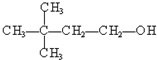 ⑤
⑤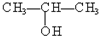
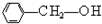 )
)