题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1L0.1mol?L-1的MgCl2溶液中,含有Cl-个数为2NA |
| B、1 molNa2O2与水充分反应转移电子总数为2NA |
| C、常温常压下,NA个NO与NA个N2和O2的混合气体的体积不相等 |
| D、5.4gAl分别与足量的稀硫酸和氢氧化钠反应,失去的电子数都是0.6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=cV,求出Cl-的物质的量,再根据N(Cl-)=n(Cl-)NA计算;
B、Na2O2与水的反应是Na2O2自身的氧化还原反应,过氧根离子中的两个O都是-1价,其中一个O被氧化至0价,另外一个O被还原至-2价,1molNa2O2与水充分反应转移1mol电子;
C、决定气体的体积的主要因素是微粒间的距离,微粒的数目,而微粒间的距离只跟温度和压强有关;
D、铝和酸与强碱溶液的反应实质都是铝和氢离子之间的氧化还原反应;
B、Na2O2与水的反应是Na2O2自身的氧化还原反应,过氧根离子中的两个O都是-1价,其中一个O被氧化至0价,另外一个O被还原至-2价,1molNa2O2与水充分反应转移1mol电子;
C、决定气体的体积的主要因素是微粒间的距离,微粒的数目,而微粒间的距离只跟温度和压强有关;
D、铝和酸与强碱溶液的反应实质都是铝和氢离子之间的氧化还原反应;
解答:
解:A、n(Cl-)=2c(MgCl2)V(MgCl2)=2×1L×0.1mol?L-1=0.2mol,所以N(Cl-)=n(Cl-)NA=0.2mol×NAmol-=0.2NA,故A错误;
B、1molNa2O2与水充分反应转移1mol电子,所以转移电子数为NA,故B错误;
C、微粒的数目相同,温度和压强一定微粒间的距离是一个定值,故NA个NO与NA个N2和O2的混合气体的体积相等,故C错误;
D、铝和酸与强碱溶液的反应实质都是铝和氢离子之间的氧化还原反应,5.4gAl是0.2mol,1molAl转移3mol电子,则0.2mol的铝转移电子数为0.6NA,故D正确;
故选D.
B、1molNa2O2与水充分反应转移1mol电子,所以转移电子数为NA,故B错误;
C、微粒的数目相同,温度和压强一定微粒间的距离是一个定值,故NA个NO与NA个N2和O2的混合气体的体积相等,故C错误;
D、铝和酸与强碱溶液的反应实质都是铝和氢离子之间的氧化还原反应,5.4gAl是0.2mol,1molAl转移3mol电子,则0.2mol的铝转移电子数为0.6NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,注意自身氧化还原反应电子转移的数目以及铝和酸碱的反应电子转移情况.

练习册系列答案
相关题目
某溶液中存在大量的Al3+、H+、SO42-,则该溶液中还可能大量存在的离子是( )
| A、OH- |
| B、Ba2+ |
| C、NH4+ |
| D、CO32- |
在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是( )
| A、NH4+ |
| B、Al3+ |
| C、Ca2+ |
| D、SO42- |
在无色透明碱性溶液中,能共存的离子组是( )
| A、Na+、CO32-、SO42-、Fe2+ |
| B、MnO4-、K+、SO42-、Na+ |
| C、K+、SO42-、HCO3-、Na+ |
| D、Ba2+、NO3-、Cl-、Na+ |
短周期元素X、Y、Z、W的原子序数依次增大,且最外层电子数之和为12.X与Z同主族,X与Y分属不同周期,Y原予的最外层电子数是电子层数的3倍,W原子的最外层电子数是次外层电子数的一半.下列说法中正确的是( )
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:Y<W |
| C、X与Y只能形成一种化合物 |
| D、Z2WY3可用来制备木材防火剂 |
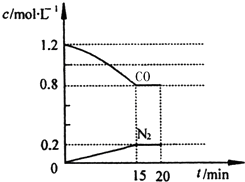 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:
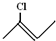 表示的分子式
表示的分子式 的键线式的表达式
的键线式的表达式 有的官能团的名称分别为
有的官能团的名称分别为