题目内容
“乙醇汽油”已在广西使用,乙醇是可再生能源.乙醇的燃烧反应是 反应(吸热或放热).
考点:吸热反应和放热反应
专题:化学反应中的能量变化
分析:根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答:
解:乙醇燃烧放出大量的热量,属于放热反应,故答案为:放热.
点评:本题考查了常见的放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
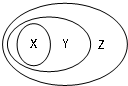 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 甲烷 | 烷烃 | 烃 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
下列反应的离子方程式书写正确的是( )
| A、碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氯化铝溶液与氨水反应:Al3++4OH-=AlO2-+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
锌粒与稀盐酸反应时,下列因素不会影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、用同质量锌粉替换锌粒 |
| C、溶液的温度 |
| D、加少量硫酸钠 |
在无色透明碱性溶液中,能共存的离子组是( )
| A、Na+、CO32-、SO42-、Fe2+ |
| B、MnO4-、K+、SO42-、Na+ |
| C、K+、SO42-、HCO3-、Na+ |
| D、Ba2+、NO3-、Cl-、Na+ |


