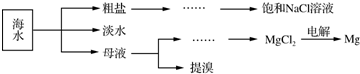
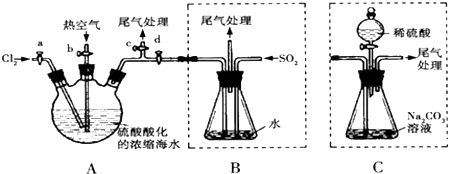
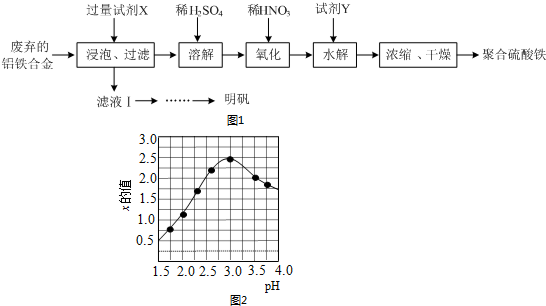
题目内容
8.除去下列物质中所含少量杂质(括号内为杂质),所选试剂和方法正确的是( )| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 过量浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴、三溴苯酚均易溶于苯;
B.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质;
C.溴与NaOH反应后,与溴苯分层;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层.
解答 解:A.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液,故A错误;
B.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气,故B错误;
C.溴与NaOH反应后,与溴苯分层,然后分液可分离,故C正确;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液可分离,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法等为解答的关键,侧重分析与应用能力的考查,注意有机物性质的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法错误的是( )
| A. | 二氧化碳和环氧丙烷在催化作用下可生成一种可降解的高聚物,可减少二氧化碳对环境的影响 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
19. 中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是③⑤①②④.(写序号)
(2)选用的指示剂是b.(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
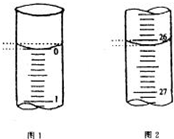
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=0.1044mol/L.
(7)滴定终点的判定依据是溶液颜色由黄色突变为橙色,且半分钟内不褪色.
 中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是③⑤①②④.(写序号)
(2)选用的指示剂是b.(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(7)滴定终点的判定依据是溶液颜色由黄色突变为橙色,且半分钟内不褪色.
16.下列表示物质或微粒的化学用语正确的是( )
| A. | HF的电子式为 | B. | Mg2+的结构示意图为 | ||
| C. | CO2的电子式为: | D. | Cl-的结构示意图为 |
3.下列说法正确的是( )
| A. | Cl2、Br2、I2的熔沸点依次升高 | |
| B. | 因为自然界中没有游离态的P元素,所以非金属性P>N | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,一定无K+ | |
| D. | 已知FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变程度相同 |
17.短周期元素X、Y、Z、W,它们的原子序数依次增大.X与Z同主族,并且原子序数之和为20.Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2.下列叙述正确的是( )
| A. | 原子半径:Z>W>Y>X | |
| B. | X的简单氢化物与足量W单质在光照条件下反应生成物均为气体 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | Y的最高价氧化物对应的水化物可与其简单氢化物发生化合反应 |
18.下列不是用来确定有机物结构或官能团的是( )
| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 质谱 | D. | 银镜反应 |