题目内容
12.锡是第IVA族金属元素,常见化合价为+2、+4价,其单质及化合物在生活、生产中有重要应用.已知:Sn熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点-33℃、沸点114℃.请按要求回答下列相关问题:(1)如图1为锡原子结构示意图,请补充完整:
(2)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.2000mol•L-1K2Cr2O7溶液滴定步骤②得到的溶液(产物中Cr呈+3价),消耗25.00mL.步骤②中加入
Fe2(SO4)3发生反应的离子方程式为2Fe3++Sn2+=2Fe2++Sn4+;此锡粉样品中锡的质量分数为75%.
(3)实验室配制SnCl2溶液时:要先将SnCl2固体溶于较浓盐酸,并在新配制的SnCl2溶液中加入锡粉,目的是防止其水解及发生氧化反应.
(4)SnO不溶于水,工业上常用于制备SnSO4.向酸性SnCl2溶液中加入碳酸氢铵溶液调PH=7,可以生成SnO,写出反应的离子方程式Sn2++2HCO3-=SnO↓+2CO2↑+H2O.
(5)现有如图2所示装置,某化学实验小组要在实验室中制备少量SnCl4,请回答下列问题:
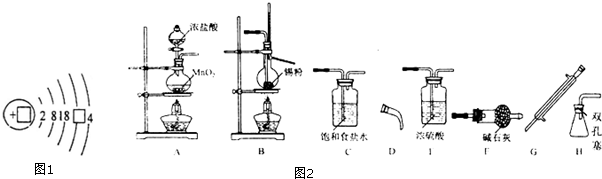
①所选择的仪器装置及合理的先后排列顺序是:A→C→E→B→G→D→H→F.
②实验中当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是锡与氯气的反应为放热反应,放出的热量维持反应继续进行.
分析 (1)由结构示意图可知,锡是第四周期第IVA族金属元素,由能量最低原理,可知原子核外电子排布式为1s22s22p63s23p63d104s24p2;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,根据元素守恒及电子得失守恒,可得关系式:3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,根据K2Cr2O7的物质的量可计算出锡的物质的量,再求得锡的质量,进而计算锡的质量分数;
(3)Sn2+易水解、易被氧化,所以实验室配制SnCl2溶液时要防止其水解及发生氧化反应;
(4)向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,同时还有二氧化碳和氯化铵生成,根据电荷守恒和元素守恒书写离子方程式;
(5)SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,所以要用饱和食盐水除去HCl,可以降低氯气的溶解,浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在B中反应生成SnCl4,经冷凝后用H装置进行收集SnCl4,未反应的氯气,用干燥管中碱石灰吸收,同时又可以防止空气中的水分进入H中使产物水解.
解答 解:(1)由结构示意图可知,锡是第四周期第IVA族金属元素,由能量最低原理,可知原子核外电子排布式为1s22s22p63s23p63d104s24p2,补充完整的原子结构示意图为 ,
,
故答案为: ;
;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,同时生成Fe2+,反应的离子方程式为:2Fe3++Sn2+=2Fe2++Sn4+,根据元素守恒及电子得失守恒,可得关系式:3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7,K2Cr2O7的物质的量为0.2000mol•L-1×0.025L=0.005mol,由关系式可知,锡的物质的量为0.005mol×3=0.015mol,则锡的质量分数为$\frac{0.015mol×119g/mol}{2.38g}$×100%=75%,
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;75%;
(3)Sn2+易水解、易被氧化,所以实验室配制SnCl2溶液时要防止其水解及发生氧化反应,要先将SnCl2固体溶于少量浓盐酸中,并在新配制的SnCl2溶液中加入少量锡粉,
故答案为:溶于较浓盐酸;锡粉;防止其水解及发生氧化反应;
(4)向酸性SnCl2溶液中加入碳酸氢铵溶液调 PH=7,可以生成SnO,同时还有二氧化碳和氯化铵生成,反应的离子方程式为Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
(5)SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,所以要用饱和食盐水除去HCl,可以降低氯气的溶解,浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在B中反应生成SnCl4,经冷凝后用H装置进行收集SnCl4,未反应的氯气,用干燥管中碱石灰吸收,同时又可以防止空气中的水分进入H中使产物水解,
①根据上面的分析可知,仪器装置及合理的先后排列顺序是A→C→E→B→G→D→H→F,
故答案为:C→E→B→G→D→H→F;
②由于锡与氯气的反应为放热反应,所以当开始生成SnCl4时即可熄灭B处酒精灯,反应仍可持续进行,
故答案为:锡与氯气的反应为放热反应,放出的热量维持反应继续进行.
点评 本题考查物质制备方案、化学工艺流程、物质含量测定、原子结构等知识,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 5:3:2 | B. | 3:2:2 | C. | 5:4:1 | D. | 3:2:1 |
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
0.06mol•L-1•h-1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动?向右移动 (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为B(填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为0.8.
(4)在100℃条件下,能说明反应CCl4+H2?CHCl3+HCl△H<O达到平衡状态的是D(填字母).
A.压强不再变化
B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变
D.H2的质量不再变化
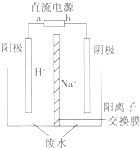
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理
简单,设备占地面积小,废水中的重金属离子也能通过电解有所降
低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,
其装置示意图如图所示.
①若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入甲醚,a极的电极反应为13O2+52e-=26O2-.
②能否用铜作电解重铬酸钠废水的电极?不能(填“能”或“不能”),理由是铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬
③除去重铬酸根离子的离子反应是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
①混合物:漂白粉、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:丙烷、异丁烷、十六烷
⑤同素异形体:H2、D2、T2( )
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ②④ |
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体 熔点为-40℃,沸点为71℃ 不溶于冷水,易溶于有机溶剂 密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
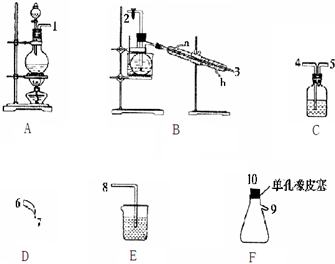
回答下列问题:
(1)根据实验目的,接口连接的顺序为1、4、5、2、3、6、7、10、9、8.
(2)C装置中盛放的试剂为饱和食盐水; E装置中盛放的试剂为NaOH溶液.
(3)A装置中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(5)当E装置的锥形瓶内有黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色;若取该液体滴入热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,写出该油状液体与热水反应的化学方程式NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3_.
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 铝粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
| A. | 氯化钠溶解度减小 | B. | 溶液中溶质的质量分数变小 | ||
| C. | 溶剂的质量减小 | D. | 溶液变成不饱和溶液 |
