题目内容
17.下列反应属于吸热反应的是( )| A. | 碳酸钙受热分解 | B. | 氧化钙溶于水 | C. | 甲烷燃烧 | D. | 铝粉与盐酸反应 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:A.碳酸钙受热分解是吸热反应,故A正确;
B.氧化钙溶于水是放热反应,故B错误;
C.甲烷燃烧,发光发热,是放热反应,故C错误;
D.铝粉与盐酸反应是放热反应,故D错误;
故选A.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
相关题目
7.下列关于氧化还原反应中电子转移数目的判断正确的是( )
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
8.常温下,下列物质既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,并且化学反应原理相同的是( )
| A. | 乙烯 | B. | 二氧化硫 | C. | 氢气 | D. | 乙烷 |
5.用图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量.下列叙述错误的是( )
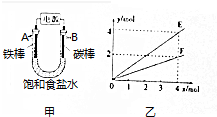

| A. | E表示反应生成NaOH的物质的量 | B. | E表示反应消耗H2O的物质的量 | ||
| C. | F表示反应生成H2或Cl2的物质的量 | D. | F表示反应消耗NaCl的物质的量 |
12.在2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O的反应中,能量转化方式为( )
| A. | 化学能转化为热能 | B. | 化学能转化为电能 | ||
| C. | 热能转化为化学能 | D. | 化学能转化为机械能 |
2.饱和食盐水露置在空气中一段时间后,有少量固体析出,这是因为( )
| A. | 氯化钠溶解度减小 | B. | 溶液中溶质的质量分数变小 | ||
| C. | 溶剂的质量减小 | D. | 溶液变成不饱和溶液 |
9.生活中的下列措施是为了改变化学反应速率的是( )
| A. | 将湿衣服放在太阳下晒干 | B. | 向较多粉尘的地面洒水后再清洁 | ||
| C. | 铁制栏杆喷涂油漆 | D. | 将食盐密封好,防止吸潮结块 |
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 常温常压下,0.01mol Na2CO3含有的Na+离子数为 0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为 22.4L | |
| D. | 物质的量浓度为 0.5mol/L 的 MgCl2溶液中,含有Cl- 个数为NA |
7.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2是气体,SiO2是固体 | |
| B. | 二氧化硅的熔点比二氧化碳高 | |
| C. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| D. | CO2通入Na2SiO3溶液中析出硅酸沉淀 |