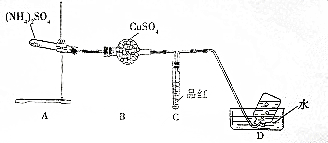
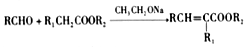题目内容
9.某有机物12g完全燃烧,生成7.2g H2O和8.96L CO2(标准状况下),0.5mol此有机物的质量为30g.(1)则有机物的分子式C2H4O2;
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,写出它的结构简式CH3COOH,它能(能、否)与NaHCO3溶液反应吗?若能,写出化学方程式CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
分析 (1)该有机物的摩尔质量为$\frac{3g}{0.5mol}$=60g/mol,计算有机物、水、二氧化碳物质的量,根据质量守恒计算式有机物中氧原子物质的量,根据原子数目之比确定有机物最简式,最后根据相对分子质量求出分子式;
(2)此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,结合分子式判断含有的官能团,确定其结构简式.
解答 解:(1)该有机物的摩尔质量为$\frac{3g}{0.5mol}$=60g/mol,
12g有机物的物质的量=$\frac{12g}{60g/mol}$=0.2mol,
7.2gH2O中H原子的物质的量为:$\frac{7.2g}{18g/mol}$×2=0.8mol,
标况下8.96LCO2的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,则n(C)=0.4mol,
12g有机物中:m(C)+m(H)=0.4mol×12g/mol+0.8mol×1g/mol=5.6g,根据质量守恒可知,有机物中含有氧原子的质量为:m(O)=12g-5.6g=6.4g,
则氧原子的物质的量为:n(O)=$\frac{6.4g}{16g/mol}$=0.4mol,
所以:n(C):n(H):n(O)=0.4mol:0.8mol:0.4mol=1:2:1,
该有机物的最简式为:CH2O,分子式为(CH2O)n,又因相对分子质量为60,即:30n=60,解得:n=2.
所以该有机物的分子式为:C2H4O2,
故答案为:C2H4O2;
(2)有机物分子式为C2H4O2,具有弱酸性,能与金属钠反应,也能与碱溶液反应,含有-COOH,结构简式为:CH3COOH,能与NaHCO3溶液反应,反应方程式为:CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O,
故答案为:CH3COOH;能;CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
点评 本题考查有机物分子式与结构式的确定,题目难度中等,掌握利用原子守恒确定有机物分子式的方法,注意掌握官能团的结构与性质的关系.

①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
已知NO、NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、CO2、H2O(g)放出1042.8kJ的热量,则△H1是( )
| A. | -867kJ•mol-1 | B. | -574kJ•mol-1 | C. | -691.2kJ•mol-1 | D. | -925.6kJ•mol-1 |
| A. | 向4mL0.01mol/LKMnO4酸性溶液中加入2mL0.1mol/LH2C2O4溶液:溶液褪色 | |
| B. | 浓度均为0.1mol/L的Na2S2O3和H2SO4溶液等体积混合:溶液变浑浊 | |
| C. | 将盛有NO2和N2O4混合气体的容器压缩:混合气体颜色比压缩前浅 |