题目内容
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的.由蛇纹石制取碱式碳酸镁的实验步骤如下: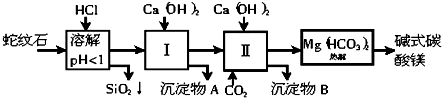
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),则沉淀物A的主要成份为 ,沉淀物B的主要成份为 .
(3)若要从沉淀物A中提取出某种可用于工业冶炼铝的原料,应先向A中加入 溶液(填物质化学式)再过滤,然后向滤液中通入过量CO2,过滤、灼烧.请写出通入CO2时发生反应的离子方程式 .
(4)为确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,称取18.2g样品完全分解后,测得产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中a= 、b= 、c= .

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),则沉淀物A的主要成份为
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的PH值 | 1.5 | 3.3 | 9.4 |
(4)为确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,称取18.2g样品完全分解后,测得产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中a=
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:电离平衡与溶液的pH专题
分析:(1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)控制溶液的pH=7~8,此时得到的沉淀A为Al(OH)3、Fe(OH)3;向溶液中通入二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀;
(3)Al(OH)3能溶于强碱;偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(4)确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量;④生成水的质量.
(2)控制溶液的pH=7~8,此时得到的沉淀A为Al(OH)3、Fe(OH)3;向溶液中通入二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀;
(3)Al(OH)3能溶于强碱;偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(4)确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量;④生成水的质量.
解答:
解:(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去,故溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+;
故答案为:Fe3+、Al3+;
(2)控制溶液的pH=7~8,铝离子和铁离子沉淀,故此时得到的沉淀A为Al(OH)3、Fe(OH)3;向溶液中通入二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,故沉淀B为CaCO3;
故答案为:Al(OH)3、Fe(OH)3;CaCO3;
(3)Al(OH)3能溶于强碱;故可A中加入氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:NaOH;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O
(a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,
故答案为:3,1,3.
故答案为:Fe3+、Al3+;
(2)控制溶液的pH=7~8,铝离子和铁离子沉淀,故此时得到的沉淀A为Al(OH)3、Fe(OH)3;向溶液中通入二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,故沉淀B为CaCO3;
故答案为:Al(OH)3、Fe(OH)3;CaCO3;
(3)Al(OH)3能溶于强碱;故可A中加入氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:NaOH;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O
| ||
故答案为:3,1,3.
点评:本题主要考查元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,难度较大.

练习册系列答案
相关题目
下列物质的分子正负电荷重心不相重合的是( )
| A、C2H2 |
| B、CO2 |
| C、NH3 |
| D、BF3 |
分类是科学研究的重要方法,下列物质分类不正确的是( )
| A、化合物:干冰、冰水混合物、烧碱、小苏打 |
| B、非电解质:乙醇、四氯化碳、氯气、葡萄糖 |
| C、胶体:泥水、豆浆、有色玻璃、云、雾 |
| D、混合物:铝热剂、纯净矿泉水、水玻璃、漂白粉 |
下列实验能达到目的是( )
A、 测定乙醇结构式 |
B、 测定硫酸浓度 |
C、 合成并检验氨 |
D、 分离并回收硝基苯中的苯 |
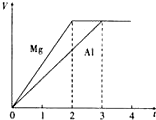 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A、物质的量之比为3:2 |
| B、质量之比为3:2 |
| C、摩尔质量之比为2:3 |
| D、单位时间内生成H2的体积之比为2:3 |

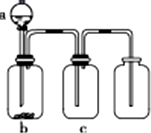 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )