题目内容
活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米.湿化学法(NPP法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如图.
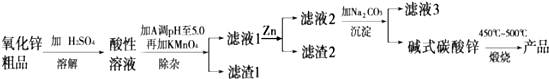
(1)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.除杂过程中所加A物质为 (填“Na2CO3”或“H2SO4”),然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2,该反应的离子方程式为 .经检测溶液中Fe2+的浓度为0.009mol/L,则每升溶液中至少应加入 mol KMnO4.
(2)已知溶液中杂质Cu2+浓度为0.0002mol/L,常温下Cu(OH)2的溶度积常数Ksp=2.2×10-20.请列式计算说明滤渣1中是否存在Cu(OH)2 .滤液1中加Zn的作用是 .
(3)滤液2所加pH=12的Na2CO3溶液中c(CO32-)=0.5mol/L,c(HCO3-)=0.01mol/L,则c(Na+):c(OH-)= .
(4)“煅烧”碱式碳酸锌[ZnCO3?2Zn(OH)2?H2O]反应的化学方程式为 .
(5)检验流程中滤液3中含有Na+的方法是 .

(1)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.除杂过程中所加A物质为
(2)已知溶液中杂质Cu2+浓度为0.0002mol/L,常温下Cu(OH)2的溶度积常数Ksp=2.2×10-20.请列式计算说明滤渣1中是否存在Cu(OH)2
(3)滤液2所加pH=12的Na2CO3溶液中c(CO32-)=0.5mol/L,c(HCO3-)=0.01mol/L,则c(Na+):c(OH-)=
(4)“煅烧”碱式碳酸锌[ZnCO3?2Zn(OH)2?H2O]反应的化学方程式为
(5)检验流程中滤液3中含有Na+的方法是
考点:制备实验方案的设计,难溶电解质的溶解平衡及沉淀转化的本质,金属的回收与环境、资源保护,物质的分离、提纯和除杂
专题:实验题
分析:由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌,
(1)溶液呈酸性,加入碳酸钠使其降低酸性,导致金属阳离子生成沉淀析出;适量KMnO4将Fe2+转化为Fe(OH)3,据此书写离子反应方程式,由电子守恒计算;
(2)依据氢氧化铜溶度积常数计算即可;
(3)pH=12的Na2CO3溶液,n(Na)=2n(C),c(OH-)=0.01mol/L;
(4)“煅烧”反应生成ZnO、二氧化碳和水;
(5)Na的焰色为黄色,以此检验.
(1)溶液呈酸性,加入碳酸钠使其降低酸性,导致金属阳离子生成沉淀析出;适量KMnO4将Fe2+转化为Fe(OH)3,据此书写离子反应方程式,由电子守恒计算;
(2)依据氢氧化铜溶度积常数计算即可;
(3)pH=12的Na2CO3溶液,n(Na)=2n(C),c(OH-)=0.01mol/L;
(4)“煅烧”反应生成ZnO、二氧化碳和水;
(5)Na的焰色为黄色,以此检验.
解答:
解:(1)溶解后得到酸性溶液,要调节溶液的pH至5.4,需要升高pH,故应加入Na2CO3,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2,离子反应方程式为:3Fe2++MnO4-+7H2O=MnO2+3Fe(OH)3+5H+,n(Fe2+)=0.009 mol,由电子得失守恒,则n(KMnO4)=
=0.003 mol,
故答案为:Na2CO3;3Fe2++MnO4-+7H2O=MnO2+3Fe(OH)3+5H+;0.003;
(2)Cu2+浓度为0.0002mol?L-1,此时pH值为5,故c(OH-)=1.0×10-9,故Qc=0.0002×(1.0×10-9)2<2.2×10-20,故此时不存在氢氧化铜,加入Zn,目的是除去铜离子,故答案为:0.0002×(1.0×10-9)2<2.2×10-20,所以滤渣1中不含有Cu(OH)2;除去铜离子;
(3)pH=12的Na2CO3溶液,由化学式可知,n(Na)=2n(C),则c(Na+)=2×0.51 mol/L=1.02 mol/L,c(OH-)=0.01mol/L,所以c(Na+):c(OH-)=102:1,故答案为:102:1;
(4)“煅烧”反应生成ZnO、二氧化碳和水,反应为ZnCO3?2Zn(OH)2?H2O
3ZnO+CO2↑+3H2O↑,故答案为:ZnCO3?2Zn(OH)2?H2O
3ZnO+CO2↑+3H2O↑;
(5)Na的焰色为黄色,则检验溶液中含有Na+,常用焰色反应,故答案为:焰色反应.
| 0.009mol |
| (7-4) |
故答案为:Na2CO3;3Fe2++MnO4-+7H2O=MnO2+3Fe(OH)3+5H+;0.003;
(2)Cu2+浓度为0.0002mol?L-1,此时pH值为5,故c(OH-)=1.0×10-9,故Qc=0.0002×(1.0×10-9)2<2.2×10-20,故此时不存在氢氧化铜,加入Zn,目的是除去铜离子,故答案为:0.0002×(1.0×10-9)2<2.2×10-20,所以滤渣1中不含有Cu(OH)2;除去铜离子;
(3)pH=12的Na2CO3溶液,由化学式可知,n(Na)=2n(C),则c(Na+)=2×0.51 mol/L=1.02 mol/L,c(OH-)=0.01mol/L,所以c(Na+):c(OH-)=102:1,故答案为:102:1;
(4)“煅烧”反应生成ZnO、二氧化碳和水,反应为ZnCO3?2Zn(OH)2?H2O
| ||
| ||
(5)Na的焰色为黄色,则检验溶液中含有Na+,常用焰色反应,故答案为:焰色反应.
点评:本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化还原反应计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、3.9 g Na2O2固体中所含的离子数为0.15NA,所含的共价键数为0.05NA |
| B、14 g C2H4和C3H6的混合物中,所含H原子数为3NA |
| C、PCl3、NO2、BF3、HClO这些分子中每个原子都达到了8电子稳定结构 |
| D、电解精炼铜时,当阳极减少3.2 g铜时,转移的电子数为0.1NA |
下列说法正确的是( )
| A、用等体积的蒸馏水或0.01mol/L盐酸洗涤AgCl沉淀,AgCl的损失量相同 |
| B、向氨水中加入NH4Cl 或Na2CO3 固体,溶液的pH均增大,水的电离程度均增大 |
| C、稀醋酸加入少量NaOH,恢复至室温后溶液的H+浓度减少,醋酸电离平衡常数不变 |
| D、NaClO与Na2CO3等物质的量混合的溶液中:c(Na+ )+c(H+)=c(OH-)+c(ClO-)+c(HCO3 -)+2c(CO32-) |
下列有关仪器使用方法或实验操作正确的是( )
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用激光笔检验KI溶液中是否溶有淀粉 |
| C、配制硫酸亚铁溶液时,应将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
| D、用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液时,应打开活塞,使乙酸乙酯缓慢流出 |
下列离子在溶液中能大量共存的是( )
| A、Fe3+ NH4+ SCN- Cl- |
| B、Ba2+ H+ NO3- SO42- |
| C、Fe3+ Fe2+ Na+ NO3- |
| D、Fe2+ NH4+ Cl- OH- |


 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下: