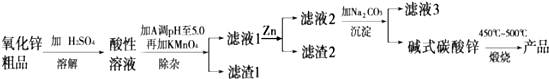
题目内容
足量MnO2与Vml10mol?L-1的浓HCl反应制Cl2,得到标况下Cl22.24L,则V应 mL.
考点:化学方程式的有关计算
专题:计算题
分析:浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,随着反应的进行,浓盐酸变成稀盐酸,稀盐酸和二氧化锰不反应.
解答:
解:浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,MnO2+4HCl(浓)
MnCl2+Cl2 ↑+2H2O,随着反应的进行,浓盐酸变成稀盐酸,稀盐酸和二氧化锰不反应,得到标况下Cl22.24L,需要盐酸的最小量为
MnO2 +4HCl(浓)
MnCl2+Cl2↑+2H2O
4mol 22.4L
0.4mol=V×10-3×10 2.24L
解得V=40,
理论上二氧化锰和浓盐酸反应生成 2.24L氯气,需要的浓盐酸为0.4mol,但实际上随着反应的进行,浓盐酸变成稀盐酸,稀盐酸和二氧化锰不反应,所以为得到 2.24L氯气,需要的盐酸应该大于40mL,
故答案为:大于40.
| ||
MnO2 +4HCl(浓)
| ||
4mol 22.4L
0.4mol=V×10-3×10 2.24L
解得V=40,
理论上二氧化锰和浓盐酸反应生成 2.24L氯气,需要的浓盐酸为0.4mol,但实际上随着反应的进行,浓盐酸变成稀盐酸,稀盐酸和二氧化锰不反应,所以为得到 2.24L氯气,需要的盐酸应该大于40mL,
故答案为:大于40.
点评:本题应明确浓盐酸能和二氧化锰反应生成氯气,而稀盐酸和二氧化锰不反应是解本题关键,再结合物质间的反应来分析解答,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y,X与Z 位于同一主族.W 与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5 倍.下列叙述中不正确的是( )
| A、X的氢化物是同主族元素氢化物中沸点最高,稳定性最好的 |
| B、WX2,YX2的化学键类型和立体构型都相同 |
| C、WX2是以极性键结合成的非极性分子 |
| D、W、Y、Z元素形成的最高价含氧酸的酸性由弱到强为Y<W<Z |
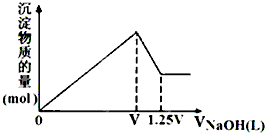 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )| A、1:1 | B、2:3 |
| C、3:1 | D、6:1 |
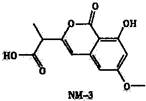 M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )
M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )| A、不含有手性碳原子 |
| B、能使溴的四氯化碳溶液褪色 |
| C、能与FeC13溶液发生显色反应 |
| D、1mo1该物质最多可与2mo1NaOH反应 |
已知氢气中1mol H-H断裂时吸收热量为436kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则1mol氢气完全燃烧生成水蒸气时放出热量( )
| A、221 kJ |
| B、557 kJ |
| C、242 kJ |
| D、188 kJ |