题目内容
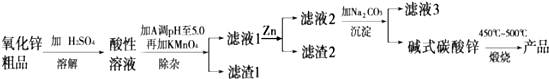
利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁.其工艺流程如下:
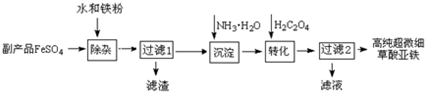
(1)检验FeSO4是否已有部分氧化的方法是 .
(2)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3.请补充化学方程式:TiOSO4+ ═H2SO4+H2TiO3↓;铁粉的作用有:①除去溶液中的Fe3+,② .
(3)沉淀反应的离子方程式是 .
(4)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致FeC2O4的产率 (填“偏高”、“偏低”或“无影响”).
(5)过滤2得到的滤液经蒸发浓缩、 、洗涤可得到副产品,该物质可用作 (写出一种用途).

(1)检验FeSO4是否已有部分氧化的方法是
(2)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3.请补充化学方程式:TiOSO4+
(3)沉淀反应的离子方程式是
(4)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(5)过滤2得到的滤液经蒸发浓缩、
考点:制备实验方案的设计,铁盐和亚铁盐的相互转变,二价Fe离子和三价Fe离子的检验,物质的分离、提纯和除杂
专题:实验题,几种重要的金属及其化合物
分析:(1)亚铁离子若被氧化,其氧化产物水铁离子,KSCN溶液遇到三价铁离子显血红色;
(2)根据反应物和生成物写出化学方程式;Fe2+具有较强的还原性,Fe可以与氢离子反应调节pH;
(3)一水合氨水是弱碱不能拆,与亚铁离子生成氢氧化亚铁沉淀,据此书写离子反应方程式即可;
(4)氨水受热易分解,难溶性碱也具有热不稳定性,据此解答即可;氢氧化亚铁能与氢离子发生反应据此解答第二个空即可;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作,该副产物为硫酸铵,可以用作化肥.
(2)根据反应物和生成物写出化学方程式;Fe2+具有较强的还原性,Fe可以与氢离子反应调节pH;
(3)一水合氨水是弱碱不能拆,与亚铁离子生成氢氧化亚铁沉淀,据此书写离子反应方程式即可;
(4)氨水受热易分解,难溶性碱也具有热不稳定性,据此解答即可;氢氧化亚铁能与氢离子发生反应据此解答第二个空即可;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作,该副产物为硫酸铵,可以用作化肥.
解答:
解:(1)亚铁离子若被氧化,其氧化产物水铁离子,KSCN溶液遇到三价铁离子显血红色,故检验方法为:取少量副产品于试管中,加适量蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液显红色,表明已有部分氧化,故答案为:取少量副产品于试管中,加适量蒸馏水溶解,滴加1~2滴KSCN溶液,若溶液显红色,表明已有部分氧化;
(2)反应物为TiOSO4和2H2O,已知为产物为H2TiO3,根据据原子守恒可知另一产物为硫酸,因此化学方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;由于Fe2+被具有很强的还原性,容易被氧化为Fe3+,铁粉的还原性比Fe2+强,因此可以防止Fe2+被氧化,另外Fe能与H+反应生成Fe2+,降低了氢离子的浓度,
故答案为:2H2O;调节溶液pH;
(3)一水合氨是弱碱,与亚铁离子生成氢氧化亚铁沉淀,氨水不能拆,沉淀不能拆,故离子反应方程式为:2NH3?H2O+Fe2+=Fe(OH)2↓+2NH4+,故答案为:2NH3?H2O+Fe2+=Fe(OH)2↓+2NH4+;
(4)氨水受热易分解生成氨气和水,氢氧化亚铁也具有热不稳定性,容易分解生成氧化物和水,由于中间产物Fe(OH)2能与H+反应,如果溶液酸性过强,则会使FeC2O4的产率下降,
故答案为:NH3?H2O和Fe(OH)2受热都易分解; 偏低;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作,该副产物为硫酸铵,可以用作化肥,故答案为:冷却结晶、过滤;化肥.
(2)反应物为TiOSO4和2H2O,已知为产物为H2TiO3,根据据原子守恒可知另一产物为硫酸,因此化学方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;由于Fe2+被具有很强的还原性,容易被氧化为Fe3+,铁粉的还原性比Fe2+强,因此可以防止Fe2+被氧化,另外Fe能与H+反应生成Fe2+,降低了氢离子的浓度,
故答案为:2H2O;调节溶液pH;
(3)一水合氨是弱碱,与亚铁离子生成氢氧化亚铁沉淀,氨水不能拆,沉淀不能拆,故离子反应方程式为:2NH3?H2O+Fe2+=Fe(OH)2↓+2NH4+,故答案为:2NH3?H2O+Fe2+=Fe(OH)2↓+2NH4+;
(4)氨水受热易分解生成氨气和水,氢氧化亚铁也具有热不稳定性,容易分解生成氧化物和水,由于中间产物Fe(OH)2能与H+反应,如果溶液酸性过强,则会使FeC2O4的产率下降,
故答案为:NH3?H2O和Fe(OH)2受热都易分解; 偏低;
(5)从溶液中得到晶体,需经过蒸发浓缩溶液、冷却结晶以及过滤洗涤等操作,该副产物为硫酸铵,可以用作化肥,故答案为:冷却结晶、过滤;化肥.
点评:本题考查氧化还原反应、离子除杂等相关知识,突出检验学生信息收集、整合、分析问题解决问题的能力,试题开放性强,有些答案不唯一,整体难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L |
| B、把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小 |
已知:①向KMnO4溶液中滴加浓盐酸,产生黄绿色气体; ②向KBr溶液中通入少量实验①产生的气体,溶液变黄色; ③取实验②生成的溶液少量滴在FeCl2与KSCN的混合溶液中,溶液变血红色.根据以上实验,下列判断正确的是( )
| A、上述实验中,共有两个氧化还原反应 |
| B、上述实验证明还原性:Fe2+>Br->Cl->Mn2+ |
| C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D、实验③证明Fe2+既有氧化性又有还原性 |