题目内容
2.下列说法正确的是( )| A. | 50℃时,测定某NaNO2溶液的pH=8,则溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | NaHSO3水溶液中存在关系:c(H2SO3)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | |||||||||
| C. | 一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| |||||||||
| D. | 已知25℃时,有关弱电解质的电离平衡常数:HCN:Ka=4.9×10-10;H2CO3:Ka1=4.3×10-7Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
分析 A.pH=8的溶液中的氢离子浓度为1×10-8mol•L-1,由于缺少该温度下水的离子积,无法计算氢氧根离子浓度,则无法计算c(Na+)-c(NO2-)的值;
B.亚硫酸氢根离子的水解程度较小,则c(H2SO3)+c(H+)<c(HSO3-);
C.0.1mol/L的醋酸溶液中的pH=3,据此可计算出氢离子浓度,然后再计算出醋酸的电离程度;
D.HCN的电离程度大于碳酸氢根离子,说明HCN的酸性大于碳酸氢根离子,则二氧化碳与NaCN溶液反应生成碳酸氢钠,不会生成碳酸钠.
解答 解:A.50℃时,测定某NaNO2溶液的pH=8,溶液中的氢离子浓度为1×10-8mol•L-1,根据电荷守恒可知c(Na+)-c(NO2-)=c(OH-)-c(H+),由于缺少水的离子积,无法计算氢氧根离子浓度,则无法计算c(Na+)-c(NO2-)的值,故A错误;
B.由于亚硫酸氢根离子的水解程度不大,则NaHSO3水溶液中一定满足:c(H2SO3)+c(H+)<c(OH-)+c(SO32-)+c(HSO3-),故B错误;
C.0.1mol/L的醋酸溶液的pH=3,氢离子浓度为0.001mol/L,由于水电离的氢离子浓度较小,则发生电离的醋酸的物质的量约为0.001mol/L,所以醋酸的电离度为:$\frac{0.001mol/L}{0.1mol/L}$×100%=1%,故C正确;
D.25℃时HCN的Ka=4.9×10-10,H2CO3的Ka2=5.6×10-11,HCN的电离程度大于碳酸氢根离子,说明HCN的酸性大于碳酸氢根离子,则二氧化碳与NaCN溶液反应生成碳酸氢钠,正确的反应为:NaCN+H2O+CO2=HCN+NaHCO3,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及弱电解质的电离平衡及其应用、盐的水解原理、离子浓度大小比较等知识,明确电荷守恒的含义、电离平衡及其影响为解答关键,试题培养了学生的灵活应用能力.

| A. | 物质内部储存的能量--化学反应的热效应 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 原子核外电子排布--元素在周期表中的位置 | |
| D. | 有效碰撞几率的高低--化学反应速率的大小 |
 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.(1)请写出Fe的基态原子核外电子排布式1s22s22p63s23p63d64s2或[Ar]3d64s2.
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为C<O<N;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为4;
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子核N原子轨道的杂化类型分别为sp2、sp3;1mol尿素分子中,σ键的数目为7NA.
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大.
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾.其中NH4-的空间构型是正四面体(用文字描述),与NO3-互为等电子体的分子是SO3或者BF3.(填化学式)
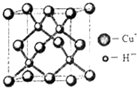
(6)铜的化合物种类很多,如图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ=$\frac{260}{{a}^{3}•{N}_{A}}$g/cm3.(用NA表示阿佛加德罗常数)
| A. | 为减少环境污染,常使用乙醇汽油代替化石燃料,乙醇可通过纤维素转化制得,是一种可再生的燃料 | |
| B. | 优良的催化剂可以降低反应温度,起到节能效果并提高反应物的转化率 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂载体等 |
| A. | HCl | B. | H2O | C. | H2O2 | D. | C2H2 |
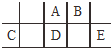 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )| A. | A有5种正价,与B可形成6种化合物 | |
| B. | 工业上常通过电解熔融态C2B3的方法来获得C的单质 | |
| C. | 简单离子的半径由大到小为:E>A>B>C | |
| D. | D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
| A. | 冰的密度小于液态水 | B. | 氨气易液化 | ||
| C. | HF的沸点高于HI | D. | 有机物普遍存在同分异构现象 |
 氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,
氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,