题目内容
18.常温下,将0.40mol/L氢氧化钠溶液与0.10mol/L硫酸溶液等体积混合,该混合溶液的pH为( )| A. | 1.0 | B. | 2.0 | C. | 13.0 | D. | 14.0 |
分析 根据酸碱溶液混合时,先判断过量,然后计算过量的酸或碱的物质的量浓度,最后根据pH=-c(H+)计算出该混合溶液的pH.
解答 解:氢氧化钠溶液物质的量浓度为0.40mol/L,设溶液的体积都是1L,则氢氧化钠的物质的量为:1L×0.40mol•L-1=0.40mol,
硫酸的物质的量为:1L×0.10mol•L-1=0.10mol,H+的物质的量为0.10mol×2=0.20mol,
则氢氧化钠过量,反应后溶液中氢氧根离子浓度为:$\frac{0.40mol-0.2mol}{2L}$=0.1mol/L,
反应后溶液中H+的物质的量浓度为c(H+)=$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L,
所以该混合物的pH=-lg1×10-13=13,
故选C.
点评 本题主要考查溶液pH的有关计算,题目难度不大,正确判断酸碱反应的过量情况为解答关键,注意熟练掌握溶液酸碱性与溶液pH的关系及溶液pH的计算方法,试题培养了学生的化学计算能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
8.下列有关化学用语表示正确的是( )
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 硫离子的结构示意图: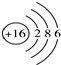 | |
| C. | H2O2的结构式:H-O-H-O | |
| D. | NH4I的电子式: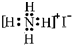 |
9.下列有关环境问题、节能减排的说法不正确的是( )
| A. | “地沟油”禁止食用,但可以用来制皂 | |
| B. | 安全、合理的使用核能有利于降低碳排放 | |
| C. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| D. | 吸烟不会造成室内PM 2.5污染 |
6.“神舟”飞船成功发射,标志着我国航天科技达到了较高水平.为了降低宇航员所在轨道舱和返回舱内二氧化碳的浓度,同时释放氧气,舱内放入下列哪种物质能满足上述要求( )
| A. | H2O | B. | Na2O2 | C. | KClO3 | D. | KMnO4 |
10.下列叙述正确的是( )
| A. | 某溶液的pH=7,则该溶液为中性溶液 | |
| B. | 一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小 | |
| C. | 常温下,反应X(s)+Y(l)═2Z(g)不能自发,则该反应的△H>0 | |
| D. | 常温下,0.01mol/L的NaOH溶液中由水电离的c(H+)=1.0×10-2mol/L |
7.将浓氨水分别滴加到下列4种溶液中,下列说法不正确的是( )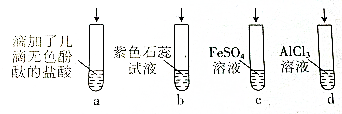

| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
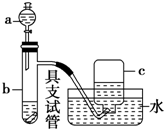 如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.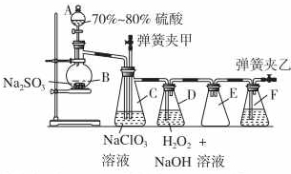 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)