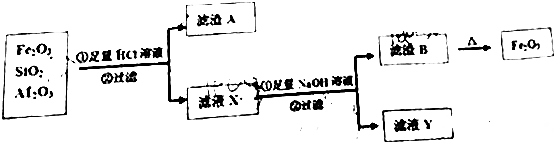
��Ŀ����
13��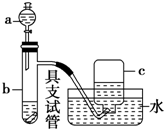 ��ͼ����Ũ���ᡢͭƬ��ˮ���Լ�̽��Ũ��ϡ�����ǿ�����Բ��۲컹ԭ�����ʵ��װ�ã�
��ͼ����Ũ���ᡢͭƬ��ˮ���Լ�̽��Ũ��ϡ�����ǿ�����Բ��۲컹ԭ�����ʵ��װ�ã���Ũ�����ǿ������ʵ��
��ͭƬ���ھ�֧�Թܵĵײ����ڷ�Һ©���м���Լ5mLŨ���ᣬ����֧�Թ��з���Լ 2mL Ũ���ᣬ����ˮ���ռ����������壮
��1����֧�Թ��з�����Ӧ�Ļ�ѧ����ʽΪCu+4HNO3��Ũ���TCu��NO3��2+2NO2��+2H2O��
��2��ʵ���й۲쵽��֤��Ũ�������ǿ�����Ե�������ͭƬ�ܽ⣬�Թ�����Һ���������к���ɫ���������
��ϡ�����ǿ������ʵ��
��3��������Ӧ��ɺ�����һ��֤��ϡ����Ҳ����ǿ�����ԣ����ӵļ�㡢������ʵ����������Թ��м�ˮ��Ũ����ϡ�ͣ�
��4����֤��ϡ������ͭ��Ӧ����NO��ʵ��������C����д���ţ���
A��c���ռ�����ɫ����
B��c���ռ�������ɫ����Ӵ��������Ϊ����ɫ
C��b�в�������ɫ����Ӵ��������Ϊ����ɫ��
���� ��1��ͭ��Ũ���ᷢ��������ԭ��Ӧ��������ͭ�Ͷ���������ˮ��
��2��ʵ����ͭ�ܽ�ͬʱ�к���ɫ������������˵��Ũ�������ǿ�����ԣ�����ͭ��������ͭ���ӣ��ݴ˴��⣻
��3��������Ӧ��ɺ����Թ��м�ˮ��Ũ����ϡ�ͳ�ϡ���ᣬ����ܼ����ܽ�ͭ����ɽ�һ��֤��ϡ����Ҳ����ǿ�����ԣ��ݴ��жϽ��
��4������һ������Ϊ��ɫ����������Ϊ����ɫ��һ���������ױ������������ɶ����������ݴ��жϽ��
��� �⣺��1��ͭ��Ũ���ᷢ��������ԭ��Ӧ��������ͭ�Ͷ���������ˮ����ѧ����ʽ��Cu+4HNO3��Ũ���TCu��NO3��2+2NO2��+2H2O��
�ʴ�Ϊ��Cu+4HNO3��Ũ���TCu��NO3��2+2NO2��+2H2O��
��2��ʵ����ͭƬ�ܽ⣬�Թ�����Һ���������к���ɫ������������˵��Ũ�������ǿ�����ԣ�����ͭ��������ͭ���ӣ�
�ʴ�Ϊ��ͭƬ�ܽ⣬�Թ�����Һ���������к���ɫ���������
��3��������Ӧ��ɺ����Թ��м�ˮ��Ũ����ϡ�ͳ�ϡ���ᣬ����ܼ����ܽ�ͭ����ɽ�һ��֤��ϡ����Ҳ����ǿ�����ԣ�
�ʴ�Ϊ�����Թ��м�ˮ��Ũ����ϡ�ͣ�
��4����b���ɵ�����Ϊ����ɫ��˵������Ϊ������������b���ɵ�����Ϊ��ɫ���Ӵ��������Ϊ����ɫ��˵����������Ϊһ����������ѡC��
�ʴ�Ϊ��C��
���� ���⿼������������ʣ���ȷ������������Ũ��֮��Ĺ�ϵ�ǽ���ؼ���ע����й����ᷴӦ�ļ�����ʱ���Ե�ԭ���غ��Ӧ�ã���Ŀ�ѶȲ���

�ٸ��¶��£�ˮ�����ӻ�����Kw=10-13��
�ڸ��¶��£�100mL 0.1mol/L��ϡ������Һ����ˮ�����c��OH-��=5��10-13mol/L��
��2��ʵ������Na2SO3������70%�����ᷴӦ��ȡSO2����ʱ������NaOH��Һ��Fe2��SO4��3��Һ���ն����SO2���壮��Fe2��SO4��3��Һ���ն����SO2���壬д��SO2��Fe2��SO4��3��Һ��Ӧ�����ӷ���ʽSO2+2Fe3++2H2O=2Fe2++SO42-+4H+
��3����Fe2��SO4��3��Һ����SO2����һ��ʱ�������Һ��һ�����ڵ�������H+��Fe2+��SO42-�ͼ�������OH-��ijͬѧ��Ϊ�����ܴ����������ӣ�������������ʵ��̽����
������������裺
����1��������HSO3-��SO32-��
����2��������Fe3+��
����3��HSO3-��SO32-��Fe3+��������
�����ʵ�鷽��
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡ��������Һ���Թ��У���ϡ�����ữ��Ȼ���ٵ��뼸��Ʒ����Һ�� | ����Ʒ�첻��ɫ ���ۣ�����1�������� |
| ����2����ȡ��������Һ���Թ��У� ���뼸��KSCN��Һ�� | ������Һ��� ���ۣ�����2������ |
| A�� | 0.1molCu��������Ũ���ᷴӦ������SO3������Ϊ0.1NA | |
| B�� | ��״���£�5.6LCO2������Na2O2��Ӧת�Ƶĵ�����Ϊ0.5NA | |
| C�� | ���³�ѹ�£�6.0g SiO2���е�SiO2������Ϊ0.1NA | |
| D�� | ��ҵ�Ͻ������������ڴ��������·���������Ӧ�����б�״����V L������ȫ��Ӧ����ת��n�����ӣ����ӵ�����NA�ɱ�ʾΪ��$\frac{22.4n}{5V}$ |
| A�� | ����� | B�� | �������� | C�� | �� | D�� | ����Ͻ� |
| A�� | 1.0 | B�� | 2.0 | C�� | 13.0 | D�� | 14.0 |
| A�� | H2O��CH4��HF | B�� | ���ס��� | ||
| C�� | CO2��SO2��NO2 | D�� | H2SO4��CH3CH2OH��HCHO |