��Ŀ����
 �ҹ��������Ϸ��ֺ�ʹ��ͭ��ͭ������Ĺ���֮һ��ֱ������ͭ���仯�����ڹ�ũҵ��������Ȼ���Ź㷺��Ӧ�ã�
�ҹ��������Ϸ��ֺ�ʹ��ͭ��ͭ������Ĺ���֮һ��ֱ������ͭ���仯�����ڹ�ũҵ��������Ȼ���Ź㷺��Ӧ�ã���1����ҵ�Ͽ����û�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ��ұ��ͭ����Ҫ��Ӧ���£�
��2CuFeS2+4O2=Cu2S+3SO2+2FeO ��2Cu2S+3O2=2SO2+2Cu2O
��Cu2S+2Cu2O=6Cu+SO2
�ڢ��б������뱻��ԭԪ��ԭ�ӵ����ʵ���֮��Ϊ
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬�������ø����ʼ��鹤ҵ��ұ��ͭ�õ��Ĵ�ͭ���Ƿ���Cu2O��д���˷�Ӧ�����ӷ���ʽ
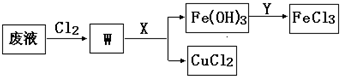
��3����ʴӡˢ��·�ķ�Һ�к��д�����CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ�Ϊ��ʹFeCl3ѭ�����úͻ���CuCl2���������ͼ�������̣�
���Լ�Y������
����������1L��Һ�к�CuCl2��FeCl2��FeCl3�����ʵ���Ũ�Ⱦ�Ϊ0.5mol?L-1�������Cl2��������Xʹ��Һ��pH��
�� KSP[Fe��OH��3]=1.0��10-38��KSP[Cu��OH��2]=2.0��10-20��lg5=0.7��
���㣺������ԭ��Ӧ�ļ���,���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���,ͭ����������Ҫ���������Ҫ����
ר�⣺������,Ԫ�ؼ��仯����
��������1����Ӧ�ۣ�Cu2S+2Cu2O=6Cu+SO2��CuԪ�ػ��ϼ���Cu2S��Cu2O��+1�۽���ΪCu��0�ۣ�Cuԭ�ӱ�������SԪ�ػ��ϼ���Cu2S��-2������ΪSO2��+4�ۣ�Sԭ�ӱ���������Ϸ���ʽ�жϣ�
���������̿�֪��CuԪ�ػ��ϼ���+2�۽���Ϊ0�ۡ�FeԪ�ػ��ϼ۲��䡢SԪ�ػ��ϼ���-2������Ϊ+4�ۣ�OԪ�ػ��ϼ���0�۽���Ϊ-2�ۣ����ݵ���ע���غ�������������ʵ�����
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬��������ͭ��Cu������Ԫ���غ��֪��������ˮ����ƽ��д���ӷ���ʽ��
��3����W�к���CuCl2��FeCl3������Xʹ������ת��Ϊ�������������������X���ڵ�����ҺpHֵ���Ҳ��������ʣ�XΪCuO�ȣ�����������Yת��Ϊ�Ȼ������ظ����ã�YΪ���
�ڸ���ͭ����Ũ�ȼ�����Һ�����pHֵ������Һ��������Ũ��Ϊ10-5mol/Lʱ������ȫ����Һ����СpHֵ���ݴ˸����ܶȻ�������Һ��������Ũ�ȣ�����������ҺpHֵ��
���������̿�֪��CuԪ�ػ��ϼ���+2�۽���Ϊ0�ۡ�FeԪ�ػ��ϼ۲��䡢SԪ�ػ��ϼ���-2������Ϊ+4�ۣ�OԪ�ػ��ϼ���0�۽���Ϊ-2�ۣ����ݵ���ע���غ�������������ʵ�����
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬��������ͭ��Cu������Ԫ���غ��֪��������ˮ����ƽ��д���ӷ���ʽ��
��3����W�к���CuCl2��FeCl3������Xʹ������ת��Ϊ�������������������X���ڵ�����ҺpHֵ���Ҳ��������ʣ�XΪCuO�ȣ�����������Yת��Ϊ�Ȼ������ظ����ã�YΪ���
�ڸ���ͭ����Ũ�ȼ�����Һ�����pHֵ������Һ��������Ũ��Ϊ10-5mol/Lʱ������ȫ����Һ����СpHֵ���ݴ˸����ܶȻ�������Һ��������Ũ�ȣ�����������ҺpHֵ��
���
�⣺��1����Ӧ�ۣ�Cu2S+2Cu2O=6Cu+SO2��CuԪ�ػ��ϼ���Cu2S��Cu2O��+1�۽���ΪCu��0�ۣ�Cuԭ�ӱ�������SԪ�ػ��ϼ���Cu2S��-2������ΪSO2��+4�ۣ�Sԭ�ӱ��������ʱ������뱻��ԭԪ��ԭ�ӵ����ʵ���֮��Ϊ1��6��
��3mol CuFeS2����3molCu�����������̿�֪��CuԪ�ػ��ϼ���+2�۽���Ϊ0�ۡ�FeԪ�ػ��ϼ۲��䡢SԪ�ػ��ϼ���-2������Ϊ+4�ۣ�OԪ�ػ��ϼ���0�۽���Ϊ-2�ۣ����ݵ���ע���غ��֪��4n��O2��+3mol��2=6mol��[4-��-2��]�����n��O2��=7.5mol��
�ʴ�Ϊ��1��6��7.5mol��
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬��������ͭ��Cu������Ԫ���غ��֪��������ˮ����Ӧ���ӷ���ʽΪ��Cu2O+2H+=Cu+Cu2++H2O��
�ʴ�Ϊ��Cu2O+2H+=Cu+Cu2++H2O��
��3����W�к���CuCl2��FeCl3������Xʹ������ת��Ϊ�������������������X���ڵ�����ҺpHֵ���Ҳ��������ʣ�XΪCuO�ȣ�����������Yת��Ϊ�Ȼ������ظ����ã�YΪ���ᣬ
�ʴ�Ϊ�����CuO��
��ͭ���ӿ�ʼ����ʱ����Һ��c��OH-��=
=
=2��10-10mol/L��c��H+��=
=5��10-5mol/L������Һ�����pH=-lg5��10-5=4.3��������Ũ�ȿ�ʼ����ʱ����Һ��c��OH-��=
=
=10-11mol/L��c��H+��=
=10-3mol/L������Һ����СpH=-lg10-3=3.0������ҺpHӦ������3.0��4.3֮�䣬
�ʴ�Ϊ��3.0��4.3��
��3mol CuFeS2����3molCu�����������̿�֪��CuԪ�ػ��ϼ���+2�۽���Ϊ0�ۡ�FeԪ�ػ��ϼ۲��䡢SԪ�ػ��ϼ���-2������Ϊ+4�ۣ�OԪ�ػ��ϼ���0�۽���Ϊ-2�ۣ����ݵ���ע���غ��֪��4n��O2��+3mol��2=6mol��[4-��-2��]�����n��O2��=7.5mol��
�ʴ�Ϊ��1��6��7.5mol��
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬��������ͭ��Cu������Ԫ���غ��֪��������ˮ����Ӧ���ӷ���ʽΪ��Cu2O+2H+=Cu+Cu2++H2O��
�ʴ�Ϊ��Cu2O+2H+=Cu+Cu2++H2O��
��3����W�к���CuCl2��FeCl3������Xʹ������ת��Ϊ�������������������X���ڵ�����ҺpHֵ���Ҳ��������ʣ�XΪCuO�ȣ�����������Yת��Ϊ�Ȼ������ظ����ã�YΪ���ᣬ
�ʴ�Ϊ�����CuO��
��ͭ���ӿ�ʼ����ʱ����Һ��c��OH-��=
|
|
| 10-14 |
| 2��10-10 |
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-11 |
�ʴ�Ϊ��3.0��4.3��
���������⿼��������ԭ��Ӧ���㼰������������������������ơ������ƶϡ��ܶȻ����йؼ���ȣ��Ѷ��еȣ���1������ע������ʼ̬����̬������˼�����ٸ��ݵ���ת���غ���㣬Ϊ�״��㡢�ѵ㣮

��ϰ��ϵ�д�
 ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
�����Ŀ
�������ӷ���ʽ��д��ȷ���ǣ�������
| A���ö��Ե缫���AgNO3��Һ��Ag++2H2O�TAg��+4H++O2�� |
| B����������ˮ��Cl2+H2O�T2H++Cl-+ClO- |
| C���������AlNH4��SO4��2?12H2O����Һ�м����������������Һ��Al3++NH4++SO42-+Ba2++5OH-�TAlO2-+BaSO4��+NH3?H2O+2H2O |
| D��̼������ڹ������CaCO3+2CH3COOH�TCa2++2CH3COO-+CO2��+H2O |
�����ӵ�����ԼΪ6.02��1023mol-1������˵������ȷ���ǣ�������
| A��1molNH3��������ȫת��ΪNOʱ��ת��5��6.02��1023e- | ||
| B��-140���£�92g�������������壬�ָ�����״��ʱ��N2O4������Ϊ6.02��1023�� | ||
| C��3.9g�����������6.02��1023��O2-���� | ||
D��1mol
|
 A��B��C��D��E��H��I�����ɶ�����Ԫ����ɵ���ѧ�������ʣ�B��D��E��GΪ���ʣ�F��һ�ֳ����Ľ��������AΪ�ȼҵ�IJ���֮һ��BԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�C��һ����ɫ��ζ��Һ�壬D��һ��������Դ���ʣ���Щ���ʵ�ת����ϵ���£���Ӧ��������ȥ����Ӧ���������ﶼ�ѱ�����ͼ�У���
A��B��C��D��E��H��I�����ɶ�����Ԫ����ɵ���ѧ�������ʣ�B��D��E��GΪ���ʣ�F��һ�ֳ����Ľ��������AΪ�ȼҵ�IJ���֮һ��BԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�C��һ����ɫ��ζ��Һ�壬D��һ��������Դ���ʣ���Щ���ʵ�ת����ϵ���£���Ӧ��������ȥ����Ӧ���������ﶼ�ѱ�����ͼ�У���
