题目内容
14.表示下列操作的离子方程式正确的是( )| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Aɡ↓+H2O | |
| C. | 向沸水中滴加FeCl3溶液制备胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 将Cl2溶于水中:Cl2+H2O═Cl-+2H++ClO- |
分析 A.电解饱和食盐水生成氢氧化钠和氢气、氯气;
B.银氨溶液氧化醛基生成羧酸;
C.氢氧化铁胶体不是沉淀;
D.次氯酸为弱酸,应保留化学式.
解答 解:A.惰性电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ Cl2↑+H2↑+2OH-,故A错误;
B.用银氨溶液检验乙醛中的醛基,离子方程式:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Ag↓+H2O,故B正确;
C.向沸水中滴加FeCl3溶液制备胶体,离子方程式:Fe3++3H2O═Fe(OH)3(胶体)+3H+,故C错误;
D.将Cl2溶于水中,离子方程式:Cl2+H2O?Cl-+H++HClO,故D错误;
故选:B.
点评 本题考查了离子方程式的正误判断和注意问题,明确离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
5.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
2.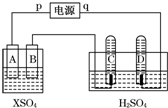 如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
(1)p为正极,A极发生了氧化反应.
(2)左侧装置在工业上的应用电镀或粗铜精炼(写出一个即可).
(3)C为阳极,C极的电极反应式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
仔细分析以上实验数据,请说出可能的原因是开始时C、D两极气体体积比为1:3,10分钟时约为1:2,说明开始时氧气溶解于溶液中.
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为64 g/mol.
 如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为正极,A极发生了氧化反应.
(2)左侧装置在工业上的应用电镀或粗铜精炼(写出一个即可).
(3)C为阳极,C极的电极反应式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体 体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| 体积(cm3) |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为64 g/mol.
9.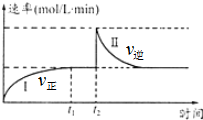 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
3.用nA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,44 g CO2气体中含有的碳原子数为nA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5nA | |
| C. | 1 mol铁与足量的稀硫酸完全反应转移的电子数为3nA | |
| D. | 1 L 1 mol•L-1 CuCl2溶液中含有的氯离子数为nA |
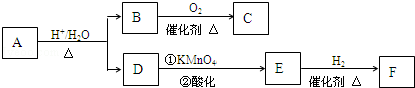
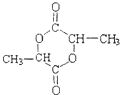 .
.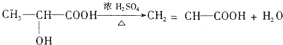 .
.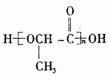 .
.
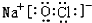


 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl.
+HCl. +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.