题目内容
13.以苯甲醛为原料合成化合物B和F的路线如下: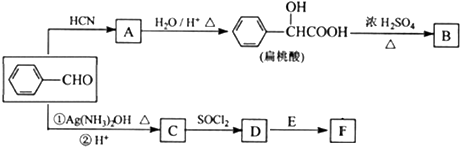
已知以下信息:
①

②化合物E的名称为对甲基苯酚
③
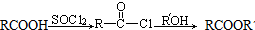 (R、Rˊ代表烃基)
(R、Rˊ代表烃基)④甲醛的4个原子处于同一平面上
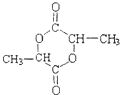
⑤化合物B的分子式为C16H12O4,分子结构中有3个六元环
回答下列问题:
(1)苯甲醛中最多有14个原子共平面,由苯甲醛生成A的反应类型是加成反应.
(2)化学物B的结构简式为
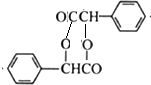 ,化合物C中的含氧官能团的名称是羧基.
,化合物C中的含氧官能团的名称是羧基.(3)化合物F与足量氢氧化钠反应的化学方程式为
 .
.(4)苯甲醛的同系物G比苯甲醛相对分子质量大28,G的同分异构体中能同时满足如下条件:①遇氯化铁溶液显紫色;②除苯环外,不含其他环状结构,共有16 种(不考虑立体异构).G的一个同分异构体发生银镜反应,苯环上取代基互不相邻,核磁共振氢谱为四组峰,且峰面积比为1:2:6:1,写出G的这种同分异构体的结构
简式
 .
.(5)写出以乙醛为原料合成丙炔酸(CH≡C-COOH)的路线(其它试剂任选).
(合成路线常用的表示方式为:反A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
分析 根据题中各物质的转化关系,苯甲醛与HCN发生加成反应生成A为 ,A酸化得扁桃酸,根据B的分子式可知,两分子扁桃酸发生酯化形成环酯B为
,A酸化得扁桃酸,根据B的分子式可知,两分子扁桃酸发生酯化形成环酯B为 ,苯甲醛发生氧化反应生成C为
,苯甲醛发生氧化反应生成C为 ,C与SOCl2发生取代生成D为
,C与SOCl2发生取代生成D为 ,D与对甲基苯酚
,D与对甲基苯酚
发生信息③中的反应生成F为 ,以乙醛为原料合成丙炔酸(CH≡C-COOH),可以用乙醛与HCN发生加成反应再水解酸化得CH3CHOHCOOH,CH3CHOHCOOH再发生消去反应得CH2=CH-COOH,CH2=CH-COOH与溴发生加成反应得CH2BrCHBr-COOH,CH2BrCHBr-COOH再发生消去反应可得CH≡C-COOH,据此答题;
,以乙醛为原料合成丙炔酸(CH≡C-COOH),可以用乙醛与HCN发生加成反应再水解酸化得CH3CHOHCOOH,CH3CHOHCOOH再发生消去反应得CH2=CH-COOH,CH2=CH-COOH与溴发生加成反应得CH2BrCHBr-COOH,CH2BrCHBr-COOH再发生消去反应可得CH≡C-COOH,据此答题;
解答 解:根据题中各物质的转化关系,苯甲醛与HCN发生加成反应生成A为 ,A酸化得扁桃酸,根据B的分子式可知,两分子扁桃酸发生酯化形成环酯B为
,A酸化得扁桃酸,根据B的分子式可知,两分子扁桃酸发生酯化形成环酯B为 ,苯甲醛发生氧化反应生成C为
,苯甲醛发生氧化反应生成C为 ,C与SOCl2发生取代生成D为
,C与SOCl2发生取代生成D为 ,D与对甲基苯酚
,D与对甲基苯酚
发生信息③中的反应生成F为 ,
,
(1)根据苯甲醛的结构简式可知,苯环上的所有原子可以共面,碳氧双键上的所有原子可以共面,单键可以转动,所以分子中最多有14个原子共平面,根据上面的分析可知,由苯甲醛生成A的反应类型是加成反应,
故答案为:14;加成反应;
(2)根据上面的分析可知,化学物B的结构简式为  ,C为
,C为 ,化合物C中的含氧官能团的名称是羧基,
,化合物C中的含氧官能团的名称是羧基,
故答案为: ;羧基;
;羧基;
(3)F为 ,化合物F与足量氢氧化钠反应的化学方程式为
,化合物F与足量氢氧化钠反应的化学方程式为 ,
,
故答案为: ;
;
(4)苯甲醛的同系物G比苯甲醛相对分子质量大28,即G中比苯甲醛多两个CH2,根据条件:①遇氯化铁溶液显紫色,说明有酚羟基;②除苯环外,不含其他环状结构,则符合条件的同分异构体为苯环上连有-OH、-CH2CH=CH2,或苯环上连有-OH、-C(CH3)=CH2,每种都有邻间对三种,或苯环上连有-OH、-CH3、-CH=CH2,根据定二动一的原则,有10种结构,所以共有3+3+10=16种,G的一个同分异构体发生银镜反应,苯环上取代基互不相邻,核磁共振氢谱为四组峰,且峰面积比为1:2:6:1,则符合条件的G的同分异构体的结构
简式为 ,
,
故答案为:16; ;
;
(5)以乙醛为原料合成丙炔酸(CH≡C-COOH),可以用乙醛与HCN发生加成反应再水解酸化得CH3CHOHCOOH,CH3CHOHCOOH再发生消去反应得CH2=CH-COOH,CH2=CH-COOH与溴发生加成反应得CH2BrCHBr-COOH,CH2BrCHBr-COOH再发生消去反应可得CH≡C-COOH,合成路线为CH3CHO$\stackrel{HCN}{→}$CH3CHOHCHO$→_{△}^{水、酸化}$CH3CHOHCOOH$→_{△}^{浓硫酸}$CH2=CH-COOH$\stackrel{Br_{2}}{→}$CH2BrCHBr-COOH$\stackrel{NaOH醇溶液}{→}$CH≡C-COOH,
故答案为:CH3CHO$\stackrel{HCN}{→}$CH3CHOHCHO$→_{△}^{水、酸化}$CH3CHOHCOOH$→_{△}^{浓硫酸}$CH2=CH-COOH$\stackrel{Br_{2}}{→}$CH2BrCHBr-COOH$\stackrel{NaOH醇溶液}{→}$CH≡C-COOH.
点评 本题综合考查有机物的合成,侧重于有机物的结构和性质的考查,多角度考查学生的分析能力,注意把握题给信息以及有机物的官能团的性质,难度中等.

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| A. | 在Na2CO3溶液中一定有:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| B. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 在NH4Cl溶液中一定有:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 在CH3COONa溶液中一定有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
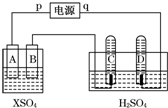 如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为正极,A极发生了氧化反应.
(2)左侧装置在工业上的应用电镀或粗铜精炼(写出一个即可).
(3)C为阳极,C极的电极反应式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体 体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| 体积(cm3) |
(5)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为64 g/mol.
| A. | 标准状况下,44 g CO2气体中含有的碳原子数为nA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5nA | |
| C. | 1 mol铁与足量的稀硫酸完全反应转移的电子数为3nA | |
| D. | 1 L 1 mol•L-1 CuCl2溶液中含有的氯离子数为nA |
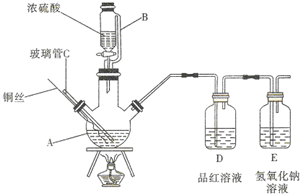 如图为某实验小组同学设计的铜与浓硫酸反应的实验装置,实验步骤如下:
如图为某实验小组同学设计的铜与浓硫酸反应的实验装置,实验步骤如下: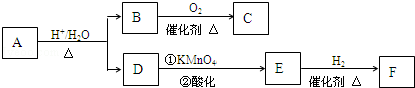
 .
.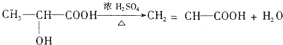 .
.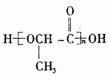 .
. .
.