题目内容
11.电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:(1)电池的正极是氧化银,正极发生的是还原反应(填反应类型).
(2)放电一段时间后,电解质溶液的碱性不变(填变小、变大、不变).
(3)当转移4mol电子时,负极质量减轻130克.
(4)电池总方程式Zn+Ag2O=2Ag+ZnO.
分析 钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-.
(1)正极上得电子发生还原反应,元素化合价降低;
(2)正负极电极反应式相加即得电池反应式,根据总反应判断;
(3)根据关系式Zn~2e-计算;
(4)正负极电极反应式相加即得电池反应式.
解答 解:(1)根据电极反应式知,氧化银中银的化合价从+1价降到0价,则正极上氧化银得电子发生还原反应,故答案为:氧化银;还原;
(2)根据电极反应式得电池反应式为Zn+Ag2O═ZnO+2Ag,所以电解质溶液的碱性不变,故答案为:不变;
(3)当转移4mol电子时,由Zn+2OH--2e-=ZnO+H2O则负极锌消耗2mol,所以质量减轻2mol×65g/mol=130g,故答案为:130;
(4)根据电极反应式得电池反应式为Zn+Ag2O═ZnO+2Ag,故答案为:Zn+Ag2O═ZnO+2Ag.
点评 本题考查了原电池原理,明确元素化合价变化是解本题关键,根据根据得失电子判断正负极电极反应及反应类型,并根据电极反应式写出电池反应式,难度不大.

练习册系列答案
相关题目
6.羟胺(NH2OH)是一种还原剂.现用25.00mL0.049mol•L-1的羟胺的酸性溶液跟足量的Fe2(SO4)3溶液在煮沸条件下反应,生成Fe2+离子恰好与24.5mL0.020049mol•L-1 的酸性KMnO4溶液完全作用生成Fe2(SO4)3,KMnO等物质,则上述反应中羟胺的氧化产物是( )
| A. | N2O | B. | N2 | C. | NO | D. | NO2 |
16.下列叙述正确的是( )
| A. | 核外电子排布完全相同的两种微粒的化学性质一定相同 | |
| B. | 单原子形成的离子一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两种粒子一定属于同种元素 | |
| D. | 不存在质子数和电子数分别相同的阳离子和阴离子 |
1.下列关于“摩尔”的理解不正确的是( )
| A. | 摩尔是国际单位制中的一种物理量 | B. | 摩尔是物质的量的单位 | ||
| C. | 摩尔简称摩,它的符号是mol | D. | 1 mol氧原子可表示为“1 mol O” |
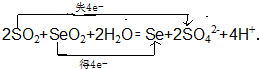 .
.
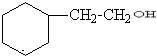 .
.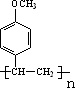 .
.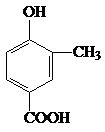 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.
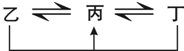 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: .
.