题目内容
18.废电池的污染引起人们的广泛关注,废电池对环境污染的主要物质是( )| A. | 石墨 | B. | 二氧化锰 | C. | 锌 | D. | 汞 |
分析 废电池里含有大量重金属汞、镉、锰、铅等.当废电池日晒雨淋表面皮层锈蚀了,其中的重金属等有毒成分就会渗透到土壤和地下水,人们一旦食用受污染的土地生产的农作物或是喝了受污染了的水,这些有毒的重金属就会进入人的体内,慢慢的沉积下来,对人类健康造成极大的威胁.可见废旧电池对土壤、水等环境造成的污染主要是重金属污染.
解答 解:废电池里含有大量重金属汞、镉、锰、铅等,废旧电池对土壤、水等环境造成污染,控制废电池危害的根本措施是禁止生产和销售危害性大的电池,特别是含汞或镉的电池,大力开展无公害的环保型电池电池,对于废旧电池,则应当及时回收,集中进行安全处理,
故选D.
点评 本题考查废电池的危害,明确电池中的成分分析废电池的危害、环境污染等是解答的关键,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
6.一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.6 | 1.6 |
| A. | 反应在0~t1s内的平均速率v(SO2)=$\frac{0.8}{{t}_{1}}$mol•L-1•s-1 | |
| B. | 保持其他条件不变,若增大O2的浓度,到达新平衡时SO2转化率会增大 | |
| C. | 平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,平衡不移动 | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1mol O2,反应到达新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$减小 |
3.N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
5.下列关于化学平衡常数的说法中,正确的是( )
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
 、SO
、SO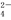 、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验: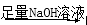 白色沉淀;
白色沉淀; 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行: 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
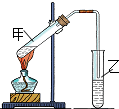 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题: