题目内容
5.设NA为阿佛加德罗常数的值,下列说法不正确的是( )| A. | 常温常压下,1mol氦气含有的原子数为NA | |
| B. | 常温常压下,8g甲烷中含有的电子数为5NA | |
| C. | 22 g CO2 与标准状况下11.2 L O2含有相同分子数 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
分析 A.He是单原子分子,每个分子中含有1个原子;
B.n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,每个甲烷分子中含有10个电子,则8g甲烷中电子的物质的量为5mol;
C.n(CO2 )=$\frac{22g}{44g/mol}$=0.5mol,n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据N=nNA计算分子数;
D.标况下,四氯化碳是液体,气体摩尔体积对其不适用.
解答 解:A.A.He是单原子分子,每个分子中含有1个原子,所以1mol氦气含有的原子数为NA,故A正确;
B.n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,每个甲烷分子中含有10个电子,则8g甲烷中电子的物质的量为5mol,8g甲烷中含有的电子数为5NA,故B正确;
C.n(CO2 )=$\frac{22g}{44g/mol}$=0.5mol,n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据N=nNA知,分子个数只与物质的量有关,物质的量相同其分子数相同,故C正确;
D.标况下,四氯化碳是液体,气体摩尔体积对其不适用,则无法计算四氯化碳物质的量,导致无法计算其分子数,故D错误;
故选D.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析判断及计算能力,明确分子构成、各个物理量关系是解本题关键,注意气体摩尔体积适用范围和适用条件,易错选项是AD.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
17.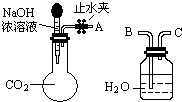 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
(3)在标况下,将4.48L CO2气体通入300mL 1mol/L 的NaOH的稀溶液中,写出该反应的离子方程式(用一个离子方程式表示)2CO2+3OH-=CO32-+HCO3-+H2O.
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
16.下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
13.常温下单质硫主要以S8(皇冠形结构)形式存在.加热时,S8会转化为S6、S4、S2等,当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )
| A. | S8转化为S6、S4、S2属于物理变化 | |
| B. | 不论哪种硫分子,完全燃烧时都生成SO3 | |
| C. | S8分子中硫原子的杂化方式是sp3杂化 | |
| D. | 把硫单质在空气中加热到750℃即得S2 |
20.龙胆酸甲酯(结构如图所示)是制备抗心律失常药物氟卡尼的中间体.正确的是( )
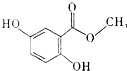

| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
10.下列反应中,属于取代反应的是( )
| A. | CH4$\stackrel{高温}{→}$C+2H2 | B. | 2HI+Cl2=2HCl+I2 | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | C2H6+Cl2$\stackrel{光}{→}$C2H5Cl+HCl |
17.最近美国宇航局马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”使火星成为第二个地球的计划.下列有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 分子中三个碳原子以单键结合成链状 | |
| C. | C3F8与C3H8互为同分异构体 | |
| D. | 全氟丙烷的电子式为 |
15.下列叙述正确的是( )
| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
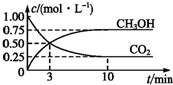 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应: