题目内容
8.写出下列物质的电离方程式:①CuCl2CuCl2═Cu2++2Cl-
②KHSO4NaHSO4═Na++H++SO42-
③CH3COOHCH3COOH?CH3COO-+H+.
分析 强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答 解:①CuCl2是强电解质,在水溶液里完全电离生成铜离子氯离子,电离方程式为CuCl2═Cu2++2Cl-;
故答案为:CuCl2═Cu2++2Cl-;
②KHSO4是强电解质,在水溶液里完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4═Na++H++SO42-;
故答案为:NaHSO4═Na++H++SO42-;
③CH3COOH是弱电解质在水溶液里部分电离,电离方程式为CH3COOH?CH3COO-+H+;
故答案为:CH3COOH?CH3COO-+H+.
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
18.一定温度下,在一个容积为1L的密闭容器中,充入1mol H2(g)和1mol I2(g),发生反应H2(g)+I2(g)?2HI(g),经充分反应达到平衡后,HI(g)的气体体积分数为50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g),则下列判断正确的是( )
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
19.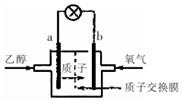 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
C2H5OH+302=2CO2+3H2O,电池示意如图.下列说法中正确的是( )
 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+302=2CO2+3H2O,电池示意如图.下列说法中正确的是( )
| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
13.光导纤维已成为信息社会必不可少的高技术材料,用于制造光导纤维的物质是( )
| A. | Si | B. | SiO2 | C. | Na2SiO3 | D. | CaSiO3 |
17.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |

 则该化合物的化学式为MgCNi3(用对应的元素符号表示).
则该化合物的化学式为MgCNi3(用对应的元素符号表示).