��Ŀ����
15����֪Ag+��±�����ӣ�Cl-��Br-��I-�����ܷ������ӷ�Ӧ�ֱ�����AgCl��AgBr��AgI��������ag�Ȼ��ơ�ag�廯�ƺ�ag�⻯���������ʣ����㣺
��1�����������������ʷֱ�����������ˮ�γ�1L��Һ�������õ����Ȼ��ơ��廯�ƺ͵⻯��������Һ�����ʵ����ʵ���Ũ�����������֣�
��2�����������������ʷֱ�����������ˮ�γ�1L��Һ��������������������Һ�����衢���ˡ�ϴ�ӡ����ɣ����յõ��ij����������������������ʵ������ܺ��Ǵ���С�����������������٣������С�����С���٣����ú�a�Ĵ���ʽ��ʾ��
���� ��1���������ʵ���������ag���γ���Һ���Ϊ1Lʱ������c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{m}{MV}$��֪�����ʵ�Ħ������Խ�����γ���Һ��Ũ��ԽС������Ȼ��ơ��廯�ƺ͵⻯�Ƶ�Ħ��������С�ж���Һ������Ũ�ȴ�С��
��2�����յõ��ij���ΪAgI��AgBr��AgCl�Ļ���������NaI��NaBr��NaClת����AgI��AgBr��AgCl������ԭ�����е������ӱ������Ӵ��棬�����յõ��ij����������������������ʵ������ܺʹ���m=nM���������������
��� �⣺��1����������ag����Һ���Ϊ1Lʱ������c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{m}{MV}$��֪�����ʵ�Ħ������Խ�����γ���Һ��Ũ��ԽС������Ħ��������СΪ��NaI��NaBr��NaCl�������ɵ���Һ�����ʵ����ʵ���Ũ������ΪNaCl��
�����õ����Ȼ��ơ��廯�ƺ͵⻯��������Һ�����ʵ����ʵ���Ũ��������NaCl��
��2����Ӧ��������NaI��NaBr��NaClת����AgI��AgBr��AgCl������ԭ�����е������ӱ������Ӵ��棬�����յõ��ij����������������������ʵ������ܺʹ���������Ϊ�����������������ӵ������������108-23��g/mol����$\frac{ag}{150g/mol}$+$\frac{ag}{103g/mol}$+$\frac{ag}{58.5g/mol}$��=85��$\frac{1}{150}$+$\frac{1}{103}$+$\frac{1}{58.5}$��ag��
�����յõ��ij����������������������ʵ������ܺ�����ˣ���������Ϊ85��$\frac{1}{150}$+$\frac{1}{103}$+$\frac{1}{58.5}$��ag��
���� ���⿼�������ʵ���Ũ�ȵļ��㣬��Ŀ�Ѷ��еȣ���ȷ���ʵ���Ũ�ȼ�������Ӧ��ʵ��Ϊ���ؼ���ע���������ʵ��������ʵ���Ũ�ȡ�Ħ������֮��Ĺ�ϵ������������ѧ�������Ӧ��������

| A�� | CH3Cl | B�� | CH2Cl2 | C�� | CCl4 | D�� | HCl |
| A�� | Cu��OH��2+HCl��Cu��OH��2+CH3COOH | B�� | NaHSO4+NaOH��H2SO4+NaOH | ||
| C�� | NaHCO3+H2SO4��Na2CO3+HCl | D�� | BaCl2��Na2SO4��Ba��OH��2��CuSO4 |
 ��֪������Ԫ��A��B��C��D����������Ӧˮ����ֱ�ΪX��Y��Z��W��A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ�������X��Z��W������Y��Ӧ��A��C��D��ԭ��������0.1 mol/LX��Z��W��Һ��pH��ͼ��ʾ������˵����ȷ���ǣ�������
��֪������Ԫ��A��B��C��D����������Ӧˮ����ֱ�ΪX��Y��Z��W��A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ�������X��Z��W������Y��Ӧ��A��C��D��ԭ��������0.1 mol/LX��Z��W��Һ��pH��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | B��D�γɵĻ������W������ͬ�Ļ�ѧ�������뾧������ | |
| B�� | C�⻯���ȶ��Դ���D�⻯���ȶ��ԣ�����ˮ��Һ������D����C | |
| C�� | B��C���γɵĻ�����ȿ�����B��C�ĵ������Ӧ�Ƶã�Ҳ���ɺ�B��CԪ�ؼ����ӵ�����Һ���Ӧ�Ƶ� | |
| D�� | A��B��C��D����Ԫ�ؾ��ڵ������ڣ�����ԭ�Ӱ뾶��������Ӧ�����ӵİ뾶���μ�С |
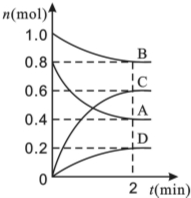 T��ʱ�����ݻ�Ϊ0.5L���ܱ������з���ijһ��Ӧ���Ҳ�ò�ͬʱ����������������A��B��C��D�����ʵ����仯��ͼ��ʾ����֪������A��B��C��Ϊ��̬��DΪ��̬������Ӧʱ���ȷ�Ӧ������Ҫ��ش��������⣺
T��ʱ�����ݻ�Ϊ0.5L���ܱ������з���ijһ��Ӧ���Ҳ�ò�ͬʱ����������������A��B��C��D�����ʵ����仯��ͼ��ʾ����֪������A��B��C��Ϊ��̬��DΪ��̬������Ӧʱ���ȷ�Ӧ������Ҫ��ش��������⣺ B��H2O��0.002mol•L��1
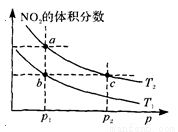
B��H2O��0.002mol•L��1 N204(g) ��H=һ57kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��N02�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���� ( )
N204(g) ��H=һ57kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��N02�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���� ( )