题目内容
20.锌和盐酸反应生成氢气和氯化锌,实验室用6.5g锌和足量盐酸反应,可以制得氢气和氯化锌的质量各是多少?分析 n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,根据转移电子相等计算生成氢气质量,根据Zn原子守恒计算n(ZnCl2),再根据m=nM计算氯化锌质量.
解答 解:n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,根据转移电子相等得m(H2)=$\frac{0.1mol×2}{2}×2g/mol$=0.2g;
根据Zn原子守恒得n(ZnCl2)=n(Zn)=0.1mol,则m(ZnCl2)=0.1mol×136g/mol=13.6g,
答:制得氢气、氯化锌的质量分别是0.2g、13.6g.
点评 本题考查化学方程式的计算,为高频考点,明确各个物理量关系是解本题关键,注意原子守恒、转移电子守恒的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.利用下列装置不能达到目的是( )


| A. | 图1装置用于二氧化硫尾气的吸收 | |
| B. | 图2装置用于验证Na和水反应的热效应 | |
| C. | 加热图3装置中的烧杯,分离SiO2和NH4Cl | |
| D. | 图4装置用于证明氧化性:Cl2>Br2>I2 |
3.现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复).
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性.
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失.
③M溶液与另外四种溶液反应都能产生沉淀.
下列说法正确的是( )
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失.
③M溶液与另外四种溶液反应都能产生沉淀.
下列说法正确的是( )
| A. | N溶液与过量的F溶液反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E溶液与N溶液混合发生反应的离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| C. | M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中 | |
| D. | 将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-═CO2↑+H2O |
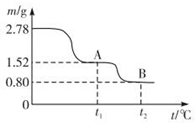 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.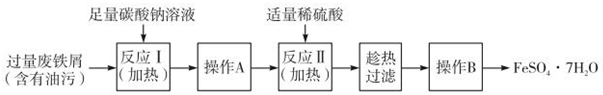
 基本不变”)。
基本不变”)。
 ,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。