题目内容
2.一定温度下,1mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
分析 A.依据方程式计算消耗的X,再根据v=$\frac{△c}{t}$计算;
B.反应过程中混合气体的压强始终不变;
C.固体对化学反应速率和化学平衡都没有影响;
D.再充入1molX,反应物的浓度增大,平衡向正反应移动.
解答 解:A.5min后达到平衡,此时生成2a mol Z,由方程式可知,消耗的X为amol,则v(X)=$\frac{\frac{amol}{2L}}{5min}$=0.1amol•L-1•min-1,故A正确;
B.随反应进行,反应混合气体的质量减小,混合气体的质量不变,说明到达平衡,故B正确;
C.因固体和纯液体改变它的物质的量并不会改变它的浓度,因此加入1 mol M,化学平衡并不移动,故C错误;
D.向上述平衡体系中再充入1molX,反应物的浓度增大,生成物的浓度不变,所以v(正)增大,v(逆)不变,平衡向正反应移动,故D错误;
故选A.
点评 本题主要考查了化学反应速率、化学平衡移动、化学平衡状态判断等,侧重于学生的分析、计算能力的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
10.对于工业合成氨反应:N2+3H2?2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 无论如何增大H2浓度,都不能使N2转化率达到100% | |
| D. | 缩小体积,υ正增大,υ逆减小,平衡正向移动 |
11.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.0001mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
12.在容积可变的密闭容器中,2mol N2和4mol H2在一定条件下发生反应,达到平衡时,H2的转化率为50%,则平衡时的氮气的体积分数接近于( )
| A. | 25% | B. | 28.6% | C. | 15% | D. | 20% |

 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: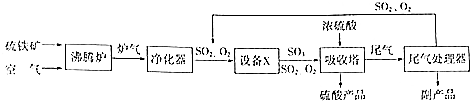 请回答下列问题:
请回答下列问题: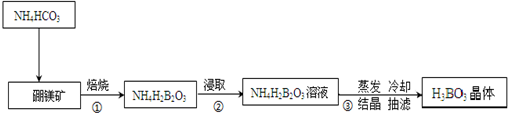
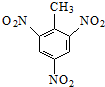 的系统命名:2,4,6-三硝基甲苯;
的系统命名:2,4,6-三硝基甲苯;