题目内容
17.硼与铝为同族元素.据报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录,硼、镁及其化合物在工农业生产中应用广泛;硼酸(H3BO3)是极弱的一元弱酸.硼镁矿主要成分为Mg2B2O5•H2O,用硼镁矿、碳铵法实验室制备硼酸的主要流程如下: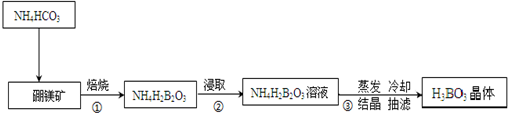
请回答:
(1)步骤①中实验室需要把硼镁矿放在坩埚仪器中焙烧(填实验仪器).
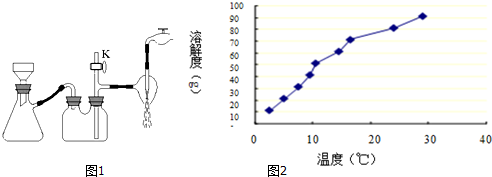
(2)步骤③中采用减压过滤,该小组同学所用的装置如图1所示,若实验过程中发现倒吸现象,应采取最简单的实验操作是打开旋塞K;从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷却结晶、抽滤、洗涤、干燥获得硼酸晶体,下列实验条件容易使得到的硼酸晶体有较大颗粒的是C.
A.较高温度下快速蒸发
B.用冰水冷却 NH4H2BO3溶液
C.采用较稀的NH4H2BO3溶液
(3)硼酸是极弱的一元弱酸,用离子方程式表示硼酸溶液显酸性的原因H3BO3?H++H2O+BO2-;硼酸溶解度如图2所示,从操作③中获得H3BO3晶体需要洗涤、干燥,洗涤过程中需要用冷水(填“冷水”或“热水”),你的理由是硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
(4)测定硼酸晶体纯度的试验方法是,取0.500 0g样品与锥形瓶中,滴加甘油,微热使样品溶解,迅速冷却至室温,滴加指示剂,用NaOH标准溶液滴定至15.80mL时到达终点.已知:每1.00mLNaOH滴定液相当于30.92mg的H3BO3,则该样品中H3BO3的质量分数为97.71%.
分析 由流程可知,硼镁矿与碳酸氢铵混合焙烧生成NH4H2BO3固体,再浸取得NH4H2BO3溶液,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3;
(1)硼镁矿焙烧时需在高温条件下,应在坩埚中进行;
(2)压过滤时因压强减小过快产生倒吸,应采取最简单的实验操作是平衡内外压强,消除倒吸;浓度、结晶速率均影响结晶颗粒的大小;
(3)硼与铝为同族元素,具有相似的性质,且硼酸是极弱的一元弱酸,电离方程式为H3BO3?H++H2O+BO2-;由硼酸溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失;
(4)根据每1.00mlNaOH滴定液相当于30.92mg的H3BO3,用NaOH标准溶液滴定至15.80ml时到达终点进行计算.
解答 解:(1)因为焙烧为高温加热固体,所以步骤①中实验室需要把硼镁矿放在坩埚中进行焙烧,故答案为:坩埚;
(2)减压过滤时因压强减小过快产生倒吸,应采取最简单的实验操作是:打开旋塞K,平衡内外压强,消除倒吸;结晶时通常采用浓度较低,溶剂蒸发速度较慢或溶液冷却较慢的条件,可获得较大的晶体颗粒,故C正确;
故答案为:打开旋塞K; C;
(3)硼与铝为同族元素,具有相似的性质,且硼酸是极弱的一元弱酸,电离方程式为H3BO3?H++H2O+BO2-;根据硼酸的溶解度曲线,硼酸溶解度随着温度升高增大较快,则H3BO3晶体的洗涤过程中需要用冷水洗涤,以减少硼酸因溶解而损失;
故答案为:H3BO3?H++H2O+BO2-;冷水;硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
(4)每1.00mlNaOH滴定液相当于30.92mg的H3BO3,用NaOH标准溶液滴定至15.80ml时到达终点,则相当于30.92mg×15.8=488.536mg=0.488536gH3BO3,所以测该样品中H3BO3的质量分数为$\frac{0.488536g}{0.5000g}$×100%=97.71%;
故答案为:97.71%.
点评 本题考查了物质制备的流程分析判断,物质性质和实验过程判断,滴定实验的操作过程和计算应用,掌握基础是关键,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案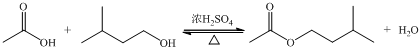
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
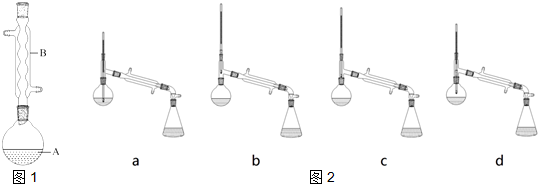
(1)仪器B的名称是:球形冷凝管
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(3)本实验中加入过量乙酸的目的是:提高醇的转化率.
(4)实验中加入少量无水MgSO4的目的是:干燥.
(5)如图2,在蒸馏操作中,仪器选择及安装都正确的是:b (填标号).
(6)本实验的产率是:d(填标号).
a.30% b.40% c.50% d.60%
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”).
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
| A. | 有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学 | |
| B. | CO、H2CO3等含碳元素的化合物视作无机物的理由是他们的组成和性质跟无机物相似 | |
| C. | 迄今为止,人类发现和合成的有机物已超过3000万种 | |
| D. | 有机物受热不易分解,且不易燃烧 |
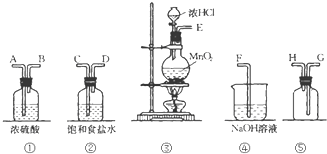 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:


