题目内容
14.按要求填写下列空白:(1)葡萄糖的结构简式CH2OH(CHOH)4CHO;
(2)
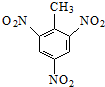 的系统命名:2,4,6-三硝基甲苯;
的系统命名:2,4,6-三硝基甲苯;(3)丙氨酸和甘氨酸的关系为:互为同系物;丙氨酸中所含官能团的名称为氨基、羧基;甘氨酸和丙氨酸混合发生缩合,能生成4种二肽化合物.
分析 (1)葡萄糖是一种多羟基的醛,分子式为C6H12O6,据此写出结构简式;
(2) 可以看做用三个硝基取代了甲苯中苯环上的三个H原子而得到;
可以看做用三个硝基取代了甲苯中苯环上的三个H原子而得到;
(3)结构相似、在分子组成上相差一个或若干个CH2原子团的化合物互为同系物;氨基酸中的官能团有氨基和羧基;两分子氨基酸发生脱水缩合反应生成含一个肽键的化合物称为二肽.
解答 解:(1)葡萄糖的分子式为C6H12O6,是一种多羟基的醛,结构中含5个-OH和1个-CHO,故结构简式为CH2OH(CHOH)4CHO,故答案为:CH2OH(CHOH)4CHO;
(2) 可以看做用三个硝基取代了甲苯中苯环上的三个H原子而得到,故甲基所在的碳原子为1号,按顺时针或逆时针给苯环上的碳原子编号,故三个硝基在2、4、6号碳原子上,故名称为:2,4,6-三硝基甲苯,故答案为:2,4,6-三硝基甲苯;
可以看做用三个硝基取代了甲苯中苯环上的三个H原子而得到,故甲基所在的碳原子为1号,按顺时针或逆时针给苯环上的碳原子编号,故三个硝基在2、4、6号碳原子上,故名称为:2,4,6-三硝基甲苯,故答案为:2,4,6-三硝基甲苯;
(3)结构相似、在分子组成上相差一个或若干个CH2原子团的化合物互为同系物,故丙氨酸和甘氨酸互为同系物;氨基酸中的官能团有氨基和羧基;两分子氨基酸发生脱水缩合反应生成含一个肽键的化合物称为二肽,故甘氨酸和丙氨酸混合发生缩合时,当同种氨基酸脱水,生成2种二肽,当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽.
所以共有4种,故答案为:互为同系物;氨基、羧基;4;
点评 本题考查氨基酸成肽键性质,难度不大,关键在于形成肽键既要考虑不同氨基酸分子间形成肽键,又要考虑同种氨基酸分子间形成肽键.

练习册系列答案
相关题目
4.有机物X的分子式为C6H10O2,在稀硫酸中加热可得到Y、Z两种物质,其中Y能使溴的CCl4溶液褪色,能与NaHCO3溶液反应且分子中只含有一个甲基,则X最多有(不考虑立体异构)( )
| A. | 7 种 | B. | 6 种 | C. | 5 种 | D. | 4 种 |
5.硫酸是一种重要的化工产品,2SO2+O2?2SO3是生产过程中的重要反应.下列对于该反应的说法中不正确的是( )
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
2.一定温度下,1mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
9.下列说法中,不正确的是( )
| A. | 有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学 | |
| B. | CO、H2CO3等含碳元素的化合物视作无机物的理由是他们的组成和性质跟无机物相似 | |
| C. | 迄今为止,人类发现和合成的有机物已超过3000万种 | |
| D. | 有机物受热不易分解,且不易燃烧 |
19.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态阳离子,甲比乙的氧化性强 | |
| C. | 甲能与冷水反应而乙不能 | |
| D. | 将甲、乙组成原电池时,乙为负极 |
3.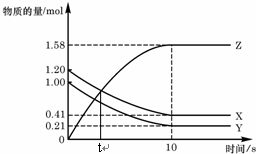 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
4.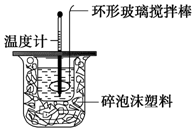 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1.则中和热△H=-53.5kJ•mol-1(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2S O4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.



