题目内容
3.下列叙述正确的是( )| A. | 16gO2所含氧原子个数约为6.02×1023 | |
| B. | 1molN2参加氧化还原反应时电子转移数约为3×6.02×1023 | |
| C. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有Cl-数约为6.02×1023 | |
| D. | 常温常压下,22.4LSO2含分子的个数约为6.02×1023 |
分析 A、氧气由氧原子构成;
B、氮气参与氧化还原反应后变为几价不明确;
C、溶液体积不明确;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、氧气由氧原子构成,故16g氧气中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,故含NA个氧原子,故A正确;
B、氮气参与氧化还原反应后变为几价不明确,则1mol氮气反应后转移的电子数无法确定,故B错误;
C、溶液体积不明确,故溶液中氯离子的个数无法计算,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化硫的物质的量小于1mol,则分子个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列有关硬水的说法中,不正确的是( )
| A. | 含有较多钙、镁离子的水叫做硬水 | |
| B. | 软水中不含有钙、镁离子 | |
| C. | 可以采取加热煮沸法和离子交接法软化硬水 | |
| D. | 硬水会降低肥皂的洗涤效果 |
14.根据下图海水综合利用的工业流程图,判断下列说法错误的是( )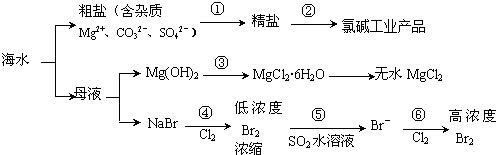

| A. | 过程①需要加入不止1种试剂,并通过合适的操作,方能把杂质除去 | |
| B. | 过程②得到的氯碱工业产品中只含有1种单质 | |
| C. | 过程③发生复分解反应 | |
| D. | 过程④、⑤、⑥均发生氧化还原反应 |
18.下列各种仪器:①漏斗;②容量瓶;③温度计;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶.常用于物质分离的是( )
| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ④⑥⑧ |
15.钢铁产量可以衡量一个国家重工业的发展水平.已知工业冶炼铁的过程中可能发生反应的热化学方程式如下:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3
④C(s)+O2(g)=CO2(g)△H4
⑤C(s)+CO2(g)=2CO(g)△H5
⑥FeO(s)+CO(g)=Fe(s)十CO2(g)△H6
下列推断不正确的是( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3
④C(s)+O2(g)=CO2(g)△H4
⑤C(s)+CO2(g)=2CO(g)△H5
⑥FeO(s)+CO(g)=Fe(s)十CO2(g)△H6
下列推断不正确的是( )
| A. | △H4<0,△H5>0 | |
| B. | △H6=$\frac{{△H}_{1}×3-{△H}_{2}-{△H}_{3}×2}{6}$ | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=$\frac{{△H}_{4}-{△H}_{3}}{2}$ | |
| D. | 2Fe3O4(s)+$\frac{1}{2}$O2(g)=3Fe2O3(s)△H=$\frac{{△H}_{4}-{△H}_{5}}{2}$-△H2 |
16.居室装修用石材的放射性常用${\;}_{88}^{226}$Ra作为标准,发现Ra元素的居里夫人(Marie Curie)曾两度获得诺贝尔奖.下列叙述中正确的是( )
| A. | ${\;}_{88}^{226}$Ra原子核外有88个电子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | RaCl2的熔点比CaCl2高 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
17.25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是( )
| A. | 该溶液的pH值可能是5 | B. | 此溶液不存在 | ||
| C. | 该溶液的pH值一定是9 | D. | 该溶液的pH值可能是7 |