题目内容
13.下列有关硬水的说法中,不正确的是( )| A. | 含有较多钙、镁离子的水叫做硬水 | |
| B. | 软水中不含有钙、镁离子 | |
| C. | 可以采取加热煮沸法和离子交接法软化硬水 | |
| D. | 硬水会降低肥皂的洗涤效果 |
分析 A.硬水中钙镁离子浓度大;
B.软水中钙镁离子浓度小;
C.加热煮沸法和离子交接法可降低钙镁离子浓度;
D.硬水中钙镁离子与高级脂肪酸根离子结合生成沉淀.
解答 解:A.硬水中钙镁离子浓度大,则含有较多钙、镁离子的水叫做硬水,故A正确;
B.软水中钙镁离子浓度小,则软水中含有钙、镁离子,故B错误;
C.加热煮沸法和离子交接法可降低钙镁离子浓度,则可以采取加热煮沸法和离子交接法软化硬水,故C正确;
D.硬水中钙镁离子与高级脂肪酸根离子结合生成沉淀,则硬水会降低肥皂的洗涤效果,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握硬水与软水的区别及降低离子浓度的方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.14C常用于测定动植物标本的年龄.关于14C原子的说法正确的是( )
| A. | 中子数为14 | B. | 质子数为14 | C. | 核外电子数为14 | D. | 质量数为14 |
4.下列各原子或离子的基态电子排布式错误的是( )
| A. | Ca2+:1s22s22p63s23p6 | B. | O:1s22s22p6 | ||
| C. | P:1s22s22p63s23p3 | D. | Br:1s22s22p63s23p63d104s24p5 |
1.废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列方法回收钴、锂.
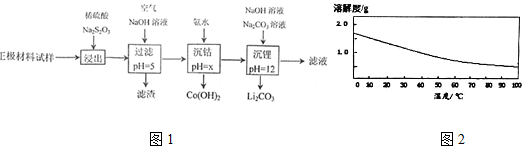
已知:
①Co(OH)2是两性氢氧化物.
②
请回答下列问题:
(1)浸出过程中为加快浸出速率,可以采取的措施有充分搅拌、升高温度(写出两点).
(2)浸出过程中Na2S2O3被氧化为Na2SO4的化学方程式为8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O.该过程中可用盐酸代替H2SO4和Na2S2O3,但缺点是生成氯气,污染环境.
(3)滤渣的成分为Al(OH)3、Fe(OH)3,充入空气的目的是将Fe2+被氧化为Fe3+.
(4)沉钴过程中不使用NaOH溶液的原因是Co(OH)2是两性氢氧化物,能与NaOH溶液反应导致沉淀的质量减少.当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,则需要控制x≥9(Ksp[Co(OH)2]=1.0×10-15).制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化成Co(OH)3,化学反应方程式为4Co(OH)2+O2+2H2O=4Co(OH)3.
(5)碳酸锂的溶解度随温度的变化如右图所示,则洗涤碳酸锂沉淀时应选热水(填“热水”或“冷水”).

已知:
①Co(OH)2是两性氢氧化物.
②
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
(1)浸出过程中为加快浸出速率,可以采取的措施有充分搅拌、升高温度(写出两点).
(2)浸出过程中Na2S2O3被氧化为Na2SO4的化学方程式为8LiCoO2+11H2SO4+Na2S2O3=4Li2SO4+8CoSO4+Na2SO4+11H2O.该过程中可用盐酸代替H2SO4和Na2S2O3,但缺点是生成氯气,污染环境.
(3)滤渣的成分为Al(OH)3、Fe(OH)3,充入空气的目的是将Fe2+被氧化为Fe3+.
(4)沉钴过程中不使用NaOH溶液的原因是Co(OH)2是两性氢氧化物,能与NaOH溶液反应导致沉淀的质量减少.当溶液中c(Co2+)≤10-5mol•L-1时即认为沉淀完全,则需要控制x≥9(Ksp[Co(OH)2]=1.0×10-15).制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化成Co(OH)3,化学反应方程式为4Co(OH)2+O2+2H2O=4Co(OH)3.
(5)碳酸锂的溶解度随温度的变化如右图所示,则洗涤碳酸锂沉淀时应选热水(填“热水”或“冷水”).
8.下列说法不正确的是( )
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 锌摄入量过多,也会引起缺铁性贫血 | |
| D. | 为了防止龋齿,人人都适合使用含氟牙膏 |
18.下列说法不正确的是( )
| A. | 磷酸的摩尔质量与阿伏加德罗常数(NA)个磷酸分子的质量在数值上相等 | |
| B. | 常温常压下,0.5NA个CO分子所占体积是11.2L | |
| C. | 1molNH4+中含有的电子数为10NA | |
| D. | 1L0.3mol/L的Na2SO4溶液中,含有Na+和 SO42-总数为0.9 NA |
5.金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料.请回答下列问题:
(1)下列关于自行车金属部件的防腐措施 不正确的是D(填标号).
A.为车架、挡泥板、车后座、车座弹簧烤上一层漆
B.为链条涂上机油,为轴承涂上凡士林
C.对车把、车圈、车辐条进行电镀处理
D.把自行车存放在阴凉、潮湿的地方
(2)家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是
铝表面形成一层致密的氧化膜,阻止内部金属进一步被氧化.
(3)某合金和铁的有关性质如下表:
又知该合金耐腐蚀、强度大.则该合金不适合用作A(填标号)
A.导线 B.门窗框 C.炉具 D.飞机外壳.
(1)下列关于自行车金属部件的防腐措施 不正确的是D(填标号).
A.为车架、挡泥板、车后座、车座弹簧烤上一层漆
B.为链条涂上机油,为轴承涂上凡士林
C.对车把、车圈、车辐条进行电镀处理
D.把自行车存放在阴凉、潮湿的地方
(2)家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是
铝表面形成一层致密的氧化膜,阻止内部金属进一步被氧化.
(3)某合金和铁的有关性质如下表:
| 熔点/℃ | 密度/g.cm-3 | 硬度 | 导电性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
A.导线 B.门窗框 C.炉具 D.飞机外壳.
2.下列物质的水溶液,既能跟氢氧化钡溶液反应,又能跟稀硫酸反应的是( )
| A. | 烧碱 | B. | 纯碱 | C. | 硝酸铜 | D. | 次氯酸 |
3.下列叙述正确的是( )
| A. | 16gO2所含氧原子个数约为6.02×1023 | |
| B. | 1molN2参加氧化还原反应时电子转移数约为3×6.02×1023 | |
| C. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有Cl-数约为6.02×1023 | |
| D. | 常温常压下,22.4LSO2含分子的个数约为6.02×1023 |