题目内容
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c (Ac-)>c (Cl-)>c (H+)>c (HAc) |
| B、c (Ac-)>c (Cl-)>c (HAc)>c(H+) |
| C、c (Ac-)=c (Cl+)>c (H+)>c (HAc) |
| D、c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,结合溶液电中性原则解答该题.
解答:
解:A.HAc为弱电解质,部分电离,应有c(HAc)>c(H+),故A错误;
B.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),HAc为弱电解质,部分电离,应有c(HAc)>c(H+),故B正确;
C.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),故C错误;
D.溶液遵循电中性原则,为c(Na+)+c(H+)=c(Ac-)+c(Cl-)c+(OH-),故D正确.
故选BD.
B.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),HAc为弱电解质,部分电离,应有c(HAc)>c(H+),故B正确;
C.反应后NaAc和HAc的物质的量相等,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),故C错误;
D.溶液遵循电中性原则,为c(Na+)+c(H+)=c(Ac-)+c(Cl-)c+(OH-),故D正确.
故选BD.
点评:本题考查离子浓度大小比较,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意反应后溶液溶质的物质的量关系,把握弱电解质电离特点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量两共存的是( )
| A、水电离产生的c(H+)=10-12的溶液:K+、Na+、ClO-、I- |
| B、c(H+)/c(OH-)=10-12的溶液:K+、AlO2-、CO32-、Na+ |
| C、硫化钠溶液:Cu2+、SO32-、Br-、H+ |
| D、pH=13的溶液:AlO2-、Cl-、HCO3-、SO42- |
已知外电路中,电子由铜流向a极.有关如图所示的装置分析合理的一项是( )


| A、该装置中Cu极为正极 |
| B、当铜极的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L |
| C、一段时间后锌片质量减少 |
| D、B极反应的电极反应式为:H2-2e-=2H+ |
 关于如图实验的叙述正确的是( )
关于如图实验的叙述正确的是( )| A、X为Cl2.生成Cl2的电极反应:2Cl-→Cl2↑+2e- |
| B、阴极材料必须使用铂做电极 |
| C、在电解过程中,阴极附近的滴液会先呈现红色 |
| D、电解饱和食盐水的化学反应方程式:2NaCl+2H2O=Cl2↑+H2↑+2NaOH |
下列表示对应化学反应的离子方程式正确的是( )
| A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+=Fe2++2H2O |
| D、澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
下列离子方程式正确的是( )
| A、NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | ||||
| B、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | ||||
| C、在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | ||||
D、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
|

 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):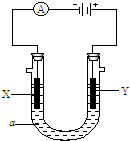 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: