题目内容
9.分析下列实例,根据已有的知识和经验,填写下表.| 实 例 | 影响速率的因素 | 如何影响 |
| 鲜牛奶变酸:28℃约4h,5℃约48h | ||
| 硫在氧气中比在空气中燃烧快 | ||
| 碳酸钙与盐酸反应:粉状比块状快 | ||
| KClO3与MnO2混合共热可快速产生O2 | ||
| 工业合成氨通常要在高压下进行 | . |
分析 影响化学反应速率的因素有:温度、浓度、接触面积、压强、催化剂等,注意各种影响因素的使用条件,以此解答该题.
解答 解:升高温度,化学反应速率一定加快,温度较高,加快了化学反应速率,所以牛奶易变质,
增大反应物的浓度,能加快反应速率,氧气的浓度大于空气中氧气的浓度,所以硫在氧气中燃烧比在空气中燃烧快,
增大反应物的接触面积,能加快反应速率,粉末状的碳酸钙比块状的碳酸钙与盐酸的接触面积大,所以反应速率快,
二氧化锰在氯化钾的分解反应中作催化剂,催化剂能降低反应需要的活化能,所以能加快反应速率,
增大压强,气体的浓度增大,反应速率加快,所以合成氨需要在高压下进行,
故答案为:
| 实 例 | 影响速率的因素 | 如何影响 |
| 鲜牛奶变酸:28℃约4h,5℃约48h | 温度 | 食物易变质 |
| 硫在氧气中比在空气中燃烧快 | 浓度 | 浓度大反应速率快 |
| 碳酸钙与盐酸反应:粉状比块状快 | 接触面积 | 接触面积大,反应速率快 |
| KClO3与MnO2混合共热可快速产生O2 | 催化剂 | 催化剂加快反应速率 |
| 工业合成氨通常要在高压下进行 | 压强 | 有气体参加的反应,增大压强,反应速率加快 |
点评 本题考查了影响化学反应速率的因素,为高频考点,注意各种影响因素的使用条件,如浓度仅使用于气体和溶液,不能使用于固体和纯液体.

练习册系列答案
相关题目
5.鉴别固体Na2CO3和NaHCO3的最好方法是( )
| A. | 分别与同浓度的稀盐酸反应 | B. | 分别加入NaOH溶液 | ||
| C. | 分别加入石灰水 | D. | 溶于水,比较其溶解性 |
17.金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示.下列说法正确的是( )
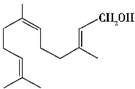

| A. | 金合欢醇与乙醇是同系物 | |
| B. | 金合欢醇可发生加成反应,但不能发生取代反应 | |
| C. | 1 mol 金合欢醇能与3 mol H2 反应,也能与3 mol Br2反应 | |
| D. | 1 mol 金合欢醇与足量Na 反应生成1mol 氢气,完全燃烧时消耗O2 21 mol |
4.下列关于原电池的叙述中,正确的是( )
| A. | 原电池能将全部化学能转变为电能 | |
| B. | 原电池的负极失电子,发生还原反应 | |
| C. | 原电池工作时,其负极不断产生电子并经外电路流向正极 | |
| D. | 原电池的电极一定要由两种不同的金属组成 |
14.下列有关说法正确的是( )
| A. | 当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 常温下2S2O(g)═3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应 | |
| D. | 氯水通入SO2后溶液的酸性减弱 |
1.下图是第二周期3~9号元素某些性质变化趋势的柱形图,下列说法正确的是( )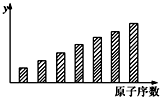

| A. | y轴表示的可能是第一电离能 | B. | y轴表示的可能是电负性 | ||
| C. | y轴表示的可能是原子半径 | D. | y轴表示的可能是元素的最高正价 |
18.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量.已知H-H 键的键能为436kJ•mol-1,Cl-Cl键的键能为243kJ•mol-1,H-Cl键的键能为431kJ•mol-1,则H2 (g )+Cl2(g )═2HCl(g ) 的反应热(△H )等于( )
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
 计算后填空:
计算后填空: