题目内容
19.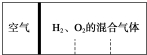 计算后填空:
计算后填空:(1)在标准状况下,448mL某气体的质量为0.64g,计算这种气体的相对分子质量为32.
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2mol•L-1,c(Cl-)=1mol•L-1.则c(Na+)为0.4mol/L.
(3)19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为24.
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol•L-1.
(5)在无土栽培中,配制1L内含5mol NH4Cl、1.6mol KCl、2.4mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为6.4mol、0.2mol.
(6)如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算气体物质的量,再根据M=$\frac{m}{n}$计算气体相对分子质量;
(2)根据电荷守恒进行计算;
(3)由n=$\frac{m}{M}$及氯化物的构成,利用离子的物质的量来列式计算;
(4)根据铁离子的质量求得铁离子的物质的量,根据化学式计算硫酸根离子的物质的量,然后除以溶液的体积即得物质的量浓度;
(5)配制的溶液中的钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量.
(6)反应前,左右两室的体积之比为1:3,则左右两室中气体物质的量之比为1:3,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.
解答 解:(1)在标准状况下,448mL某气体的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,
该气体的质量为0.64g,则其摩尔质量为$\frac{0.64g}{0.02mol}$=32g/mol,
故该气体的相对分子质量为32,故答案为:32.
(2)根据溶液中阴阳离子所带的正负电荷总数相等,则有c(Na+)×1+c(Fe3+)×3=c(Cl-)×1,即:c(Na+)×1+0.2mol/L×3=1mol/L×1,解得:c(Na+)=0.4mol/L,故答案为:0.4mol/L;
(3)设R的相对原子质量为x,
则RCl2的摩尔质量为(x+71)g/mol,
由19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,
则$\frac{19g}{(x+71)g/mol}$×2=0.4mol,
解得x=24,
故答案为:24.
(4)V L Fe2(SO4)3溶液中,含有Fe3+ m g,
则n(Fe3+)=$\frac{mg}{56g/mol}$=$\frac{m}{56}$mol,
根据化学式可得SO42-的物质的量为n(SO42-)=$\frac{3}{2}$×n(Fe3+)=$\frac{3}{2}$×$\frac{m}{56}$mol=$\frac{3m}{112}$mol,
所以SO42-的物质的量浓度为c(SO42-)=$\frac{n}{V}$=$\frac{\frac{3m}{112}mol}{VL}$=$\frac{3m}{112V}$mol/L,
故答案为:$\frac{3m}{112V}$ mol/L.
(5)在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,该培养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol;需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾中提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol,
故答案为:6.4mol;0.2mol.
(6)令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:x-2y=1 ①x+y=3 ②,解①②得x:y=7:2,
若氧气过量,则:y-0.5x=1 ①x+y=3 ②,解①②得x:y=4:5,
故答案为:7:2 或4:5.
点评 本题考查混合物的有关计算,注意(6)中左室中气体物质的量不变,根据体积变化判断右室反应前后气体物质的量,再利用赋值法与讨论法计算,难度中等.

| 实 例 | 影响速率的因素 | 如何影响 |
| 鲜牛奶变酸:28℃约4h,5℃约48h | ||
| 硫在氧气中比在空气中燃烧快 | ||
| 碳酸钙与盐酸反应:粉状比块状快 | ||
| KClO3与MnO2混合共热可快速产生O2 | ||
| 工业合成氨通常要在高压下进行 | . |

| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
| A. | CO2和CO分子组成的混合气共1mol,其中所含的分子数目为NA | |
| B. | 8.0gCuO与足量的H2充分反应生成的水在标准状况下体积为2.24L | |
| C. | 同温同压下,体积均为11.2L的CO2和SO2所含有氧原子数为NA | |
| D. | 1mol的钠离子含有NA个电子 |

| A. | 实验①、②所涉及的物质均为电解质 | |
| B. | 实验②、③均为放热反应实验 | |
| C. | ②、③均未发生氧化还原反应 | |
| D. | 实验①、③反应制得的物质均为纯净物 |
①浊液 ②乳液 ③溶液 ④烟 ⑤雾 ⑥氢氧化铁胶体.
| A. | 只有⑥ | B. | ④⑤⑥ | C. | ①③⑤ | D. | 全部 |
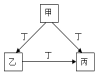 甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )
甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )| A. | Al(OH)3 | B. | FeCl3 | C. | CO | D. | Na2CO3 |