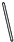题目内容
某化学兴趣小组的同学利用图1所示实验装置进行NH3、Cl2的制备、性质等实验(图中夹持装置有省略).请按要求填空.
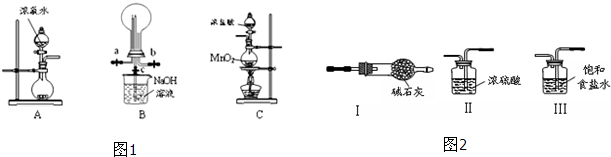
供选择的装置(图2):
(1)装置A除可制备NH3外,还可制备其他多种气体,写出制备其中一种气体的化学方程式 .
(2)为制取干燥氨气,可将装置A与装置 (填编号,从供选择的装置中选取)连接;装置A中的烧瓶内固体宜选用 (选填以下选项的代号).
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(3)若欲制取纯净、干燥的氯气,可从I、II、III装置中选取合适的装置与C依次相连.则连接次序为C、 (填编号);
(4)①实验中装置B的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式 ,请设计一个实验方案鉴定该固体中的阳离子 ;
(5)②实验完毕后观察到B烧瓶内还有黄绿色气体,简述如何处理才能不污染环境 .

供选择的装置(图2):
(1)装置A除可制备NH3外,还可制备其他多种气体,写出制备其中一种气体的化学方程式
(2)为制取干燥氨气,可将装置A与装置
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(3)若欲制取纯净、干燥的氯气,可从I、II、III装置中选取合适的装置与C依次相连.则连接次序为C、
(4)①实验中装置B的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式
(5)②实验完毕后观察到B烧瓶内还有黄绿色气体,简述如何处理才能不污染环境
考点:氯气的实验室制法,氨的实验室制法
专题:
分析:(1)依据反应物的状态和反应条件选择合适的发生装置;
(2)氨气为碱性气体,应选择碱性干燥剂;生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出;
(3)依据氯化氢、水加热易挥发,氯化氢易溶于水,浓硫酸具有吸水性解答;
(4)实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,是生成的氯化氢和氨气反应生成的氯化铵;依据铵根离子的检验方法是和碱反应生成氨气设计实验检验;
(5)氯气有毒不能直接排到空气 中,氯气能够与氢氧化钠反应,可用氢氧化钠吸收过量的氯气.
(2)氨气为碱性气体,应选择碱性干燥剂;生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出;
(3)依据氯化氢、水加热易挥发,氯化氢易溶于水,浓硫酸具有吸水性解答;
(4)实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,是生成的氯化氢和氨气反应生成的氯化铵;依据铵根离子的检验方法是和碱反应生成氨气设计实验检验;
(5)氯气有毒不能直接排到空气 中,氯气能够与氢氧化钠反应,可用氢氧化钠吸收过量的氯气.
解答:
解:(1)用装置A制备的气体,反应物状态为固体和液体不加热,锌与稀硫酸在常温下能够反应生成氢气和硫酸锌,可以用A制备,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
故答案为:Zn+H2SO4=ZnSO4+H2↑;
(2)碱石灰为碱性干燥剂,常用来干燥氨气;生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出;
故答案为:A;D;
(3)二氧化锰与浓盐酸加热生成氯气,因为氯化氢、水加热易挥发,生成的氯气中含有氯化氢和水杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以通过盛有饱和食盐水的洗气瓶能够出去杂质氯化氢,然后通过盛有浓硫酸的洗气瓶出去水蒸气;
故答案为:Ⅲ、Ⅱ;
(4)实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,是生成的氯化氢和过量氨气反应生成的氯化铵,方程式为:3Cl2+8NH3=N2+6NH4Cl;铵根离子的检验方法是,取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;
故答案为:3Cl2+8NH3=N2+6NH4Cl;
取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;
(5)氯气有毒不能直接排到空气 中,氯气能够与氢氧化钠反应,可用氢氧化钠吸收过量的氯气,所以正确的操作是:打开止水夹C,在打开止水夹啊、或者b,向烧瓶中鼓入足量空气;
故答案为:打开止水夹C,在打开止水夹啊、或者b,向烧瓶中鼓入足量空气.
故答案为:Zn+H2SO4=ZnSO4+H2↑;
(2)碱石灰为碱性干燥剂,常用来干燥氨气;生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出;
故答案为:A;D;
(3)二氧化锰与浓盐酸加热生成氯气,因为氯化氢、水加热易挥发,生成的氯气中含有氯化氢和水杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以通过盛有饱和食盐水的洗气瓶能够出去杂质氯化氢,然后通过盛有浓硫酸的洗气瓶出去水蒸气;
故答案为:Ⅲ、Ⅱ;
(4)实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,是生成的氯化氢和过量氨气反应生成的氯化铵,方程式为:3Cl2+8NH3=N2+6NH4Cl;铵根离子的检验方法是,取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;
故答案为:3Cl2+8NH3=N2+6NH4Cl;
取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;
(5)氯气有毒不能直接排到空气 中,氯气能够与氢氧化钠反应,可用氢氧化钠吸收过量的氯气,所以正确的操作是:打开止水夹C,在打开止水夹啊、或者b,向烧瓶中鼓入足量空气;
故答案为:打开止水夹C,在打开止水夹啊、或者b,向烧瓶中鼓入足量空气.
点评:本题考查了氨气、氯气的实验室制备和净化,明确反应的原理和物质的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、酸性氧化物 二氧化碳 CO2 |
| B、酸 硫酸 H2S |
| C、碱性氧化物 氢氧化钙 Ca(OH)2 |
| D、碱 纯碱 NaOH |
下列实验操作及其先后顺序均正确的是( )
| A、先装好药品,再检查装置的气密性 |
| B、先用双手捂紧试管,再将导管插入水中检查装置的气密性 |
| C、氢气还原氧化铜的实验,先通一段时间的氢气,后检验氢气纯度,再加热 |
| D、稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
下列化合物中价键极性最小是( )
| A、MgCl2 |
| B、AlCl3 |
| C、SiCl4 |
| D、PCl5 |
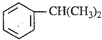 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: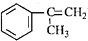 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法