题目内容
(1)为探究周期金属元素的金属活动性顺序,某学习小组用Na、Mg、Al三种金属进行了如表实验:
回答下列问题:
①将实验操作和实验现象对应起来(填字母)
②实验结论:Na、Mg、Al三种金属的金属活动性由强到弱的顺序是 ;
由此得出的一般结论是:同周期元素从左至右 .
(2)实验室用如图所示的装置制取乙酸乙酯(夹持仪器已略)回答:
①、在大试管中加入乙醇、乙酸、浓H2SO4三种
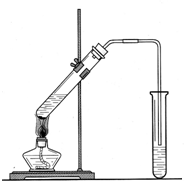
试剂的顺序是: .
②装置中长长的玻璃导管所起的作用是 ,导管末端不插入液面下是为了 .
③用饱和碳酸钠溶液吸收生成物其目的是 .
④反应结束后,若要将乙酸乙酯分离出来所用的分离方法是 .
| 实验操作 | 实验现象 |
| A、将一小块钠投入滴有酚酞的水中 | a、有气体产生,溶液变红 |
| B、将一小段除去氧化膜的镁条放入水中,加热至沸腾、冷却后滴加酚酞试液 | b、剧烈反应,迅速产生气体 |
| C、将一段除去氧化膜的镁条投入稀盐酸中 | c、反应较剧烈,有气体产生 |
| D、将一小片除去氧化膜的铝片投入与C中浓度相同的稀盐酸中 | d、金属浮于水面,溶成小球,四处游动,溶液变红,并有嘶嘶声 |
①将实验操作和实验现象对应起来(填字母)
| 实验操作 | A | B | C | D |
| 实验现象 |
由此得出的一般结论是:同周期元素从左至右
(2)实验室用如图所示的装置制取乙酸乙酯(夹持仪器已略)回答:
①、在大试管中加入乙醇、乙酸、浓H2SO4三种

试剂的顺序是:
②装置中长长的玻璃导管所起的作用是
③用饱和碳酸钠溶液吸收生成物其目的是
④反应结束后,若要将乙酸乙酯分离出来所用的分离方法是
考点:性质实验方案的设计,乙酸乙酯的制取
专题:实验题,实验设计题
分析:(1)①越是活泼的金属,和酸或者水反应越剧烈,置换出氢气越容易,生成碱的碱性越强;
②根据以上反应现象判断金属钠、镁、铝的活动性顺序,推测同周期金属性变化规律;
(2)①为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
②长导管起导气和冷凝;试管受热不均,试管中的导管伸入液面下可能发生倒吸;
③饱和碳酸钠,降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸;
④分离互不相溶的液体的操作是分液.
②根据以上反应现象判断金属钠、镁、铝的活动性顺序,推测同周期金属性变化规律;
(2)①为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
②长导管起导气和冷凝;试管受热不均,试管中的导管伸入液面下可能发生倒吸;
③饱和碳酸钠,降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸;
④分离互不相溶的液体的操作是分液.
解答:
解:(1)①金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,所以:A对应的现象为d、B对应的现象为a、C对应的现象为b、D对应的现象为c,
故答案为:
②根据金属和酸以及水的反应的剧烈程度,可以知道:金属活动性顺序为:Na>Mg>Al,同周期元素从左到右金属性逐渐减弱,
故答案为:Na、Mg、Al的金属活动性顺序由强到弱;金属性逐渐减弱;
(2)①为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸,如先加浓硫酸会出现酸液飞溅的可能现象,
故答案为:乙醇、浓硫酸、乙酸;
②长导管起导气和冷凝的作用,试管受热不均,试管中的导管伸入液面下可能发生倒吸,导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,防止倒吸,
故答案为:导气和冷凝;防止倒吸;
③制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,产物便于分层,
故答案是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
④乙酸乙酯不溶于水,可以采用分液操作,分离乙酸乙酯;
故答案是:分液.
故答案为:
| 实验步骤 | A | B | C | D |
| 实验现象 | d | a | b | c |
故答案为:Na、Mg、Al的金属活动性顺序由强到弱;金属性逐渐减弱;
(2)①为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸,如先加浓硫酸会出现酸液飞溅的可能现象,
故答案为:乙醇、浓硫酸、乙酸;
②长导管起导气和冷凝的作用,试管受热不均,试管中的导管伸入液面下可能发生倒吸,导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,防止倒吸,
故答案为:导气和冷凝;防止倒吸;
③制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,产物便于分层,
故答案是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
④乙酸乙酯不溶于水,可以采用分液操作,分离乙酸乙酯;
故答案是:分液.
点评:本题考查学生同一周期元素性质的递变规律知识,乙酸乙酯的制取,题目难度不大,试题结合试验的方式考查,增加了题目的处理难度,注意熟练掌握元素周期律的内容及其应用.

练习册系列答案
相关题目
下列离子方程式中书写正确的是( )
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |
 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.