题目内容
下列实验操作及其先后顺序均正确的是( )
| A、先装好药品,再检查装置的气密性 |
| B、先用双手捂紧试管,再将导管插入水中检查装置的气密性 |
| C、氢气还原氧化铜的实验,先通一段时间的氢气,后检验氢气纯度,再加热 |
| D、稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
考点:气体发生装置的气密性检查,化学实验操作的先后顺序
专题:化学实验基本操作
分析:A.应先检查装置的气密性,再放药品;
B.先用手捂容器外壁,里面的空气受热膨胀会早逸出;
C.要先通一段时间氢气再加热,排走空气;
D.浓硫酸的密度比水的大,并且在溶解的过程中要放出大量的热.
B.先用手捂容器外壁,里面的空气受热膨胀会早逸出;
C.要先通一段时间氢气再加热,排走空气;
D.浓硫酸的密度比水的大,并且在溶解的过程中要放出大量的热.
解答:
解:A.制备气体时,如果装置的气密性不好,就收集不到气体,故应先检查装置的气密性,再放药品,故A错误;
B.检查气密性时,要先把导管浸入水中再用手去捂容器外壁,若先用手捂容器外壁,里面的空气受热膨胀会早逸出,导致看不到导管口处冒气泡,顺序错误,故B错误;
C.氢气还原氧化铜时,要先通一段时间氢气再加热,排走空气,防止加热时防止爆炸,故C正确;
D.浓硫酸的密度比水的大,溶于水时要放出大量的热,所以在稀释浓硫酸时要将浓硫酸注入水中并不断搅拌,使放出的热量及时散失,故D错误.
故选C.
B.检查气密性时,要先把导管浸入水中再用手去捂容器外壁,若先用手捂容器外壁,里面的空气受热膨胀会早逸出,导致看不到导管口处冒气泡,顺序错误,故B错误;
C.氢气还原氧化铜时,要先通一段时间氢气再加热,排走空气,防止加热时防止爆炸,故C正确;
D.浓硫酸的密度比水的大,溶于水时要放出大量的热,所以在稀释浓硫酸时要将浓硫酸注入水中并不断搅拌,使放出的热量及时散失,故D错误.
故选C.
点评:本题考查化学实验操作的先后顺序,难度不大,了解各种操作的注意事项,具备基本的化学实验技能是学习化学和进行化学探究活动的基础和保证,只有掌握化学实验的基本技能,才能安全、准确地进行化学实验.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
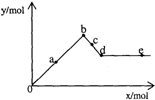 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:Ba2+不可能等于OH- |
除去某物质里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A、KNO3溶液(AgNO3):加足量KCl溶液后过滤. |
| B、NaCl溶液(Na2CO3):加足量盐酸后加热. |
| C、KNO3固体(NaCl):溶解后加热蒸发得浓溶液,降温结晶后过滤. |
| D、NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热. |
下列说法不正确的是( )
| A、△H<0、△S>0的反应在任何温度下都能自发进行 |
| B、NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C、因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
浓度均为0.1mol/L的NaOH溶液与氨水相比较,下列结论正确的是( )
| A、中和HCl的物质的量相同 |
| B、两溶液中所含的OH-数目相同 |
| C、NaOH溶液中c(H+)小 |
| D、氨水中c(OH-)大 |
 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: