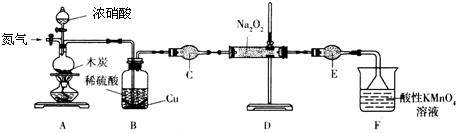
题目内容
5.常温下,乙烯和另一种烃A组成的混合气体2mol在足量空气中充分燃绕,生成89.6L的CO2(标准状况下)和86.4gH2O.试推测A的分子式以及混合气体中两种成分的体积比(写清楚计算过程)分析 先计算二氧化碳和水的物质的量,再根据混合烃的物质的量及燃烧产物计算出平均分子式,然后根据乙烯的分子式及平均分子式判断A的化学式;最后根据平均H原子数计算出二者的体积比.
解答 解:2mol混合气体充分燃烧生成89.6L的CO2(标准状况下)和86.4gH2O,二氧化碳的物质的量为$\frac{89.6L}{22.4L/mol}$=4mol,水的物质的量为$\frac{86.4g}{18g/mol}$=4.8mol水,则1mol混合气体完全燃烧生成2mol CO2和2.4mol H2O,则该混合烃的平均分子式为:C2H4.8,
乙烯的分子式为C2H4,则另一种烃分子中含有2个C原子,且H原子数大于4.8,所以烃A只能为C2H6,
设乙烯的体积为x、乙烷的体积为y,
根据平均氢原子数可得:$\frac{4x+6y}{x+y}$=4.8,整理可得:x:y=3:2,
答:A的分子式为C2H6,混合气体中乙烯和乙烷的体积比为3:2.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均分子式的含义及计算方法为解答关键,注意掌握质量守恒、平均值法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
15.芥子醇是合成工程纤维的单体,其结构简式如图所示.下列有关芥子醇的说法不正确的是( )


| A. | 芥子醇的分子式为C11H14O4 | |
| B. | 芥子醇分子中所有碳原子可能在同一平面上 | |
| C. | 1 mol该化合物在一定条件下最多可与2molNaOH反应 | |
| D. | 芥子醇在一定条件下能发生氧化、取代、加成、酯化反应 |
13.目前人工合成高效青蒿素主要采用青蒿酸为原料半合成法.青蒿酸的结构简式如图A所示.下列有关说法正确的是( )


| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与B互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
20.有机物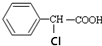 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )| A. | 6种 | B. | 9种 | C. | 15种 | D. | 19种 |
3. 某研究性学习小组用PH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的PH值(选用酚酞作为指示剂)
某研究性学习小组用PH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的PH值(选用酚酞作为指示剂)
①实验过程中需要使用的仪器有铁架台、滴定管夹、碱式滴定管、胶头滴管、酸式滴定管、锥形瓶,
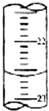
②如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
③如何判断滴定到达终点当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色.
③根据下列数据:
请计算待测NaOH溶液的浓度(保留两位小数)0.0800mol/L.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:BD.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、酸式滴定管尖嘴部分有气泡,滴定后消失.
 某研究性学习小组用PH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的PH值(选用酚酞作为指示剂)
某研究性学习小组用PH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的PH值(选用酚酞作为指示剂)①实验过程中需要使用的仪器有铁架台、滴定管夹、碱式滴定管、胶头滴管、酸式滴定管、锥形瓶,
②如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
③如何判断滴定到达终点当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色.
③根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:BD.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、酸式滴定管尖嘴部分有气泡,滴定后消失.
10.将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+.据此判断下列说法正确的是( )
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.8 NA | |
| D. | 此实验条件下,物质的氧化性:NaBiO3>KMnO4>Cl2 |
7.下列卤代烃能发生消去反应且消去产物唯一的是( )
| A. | CH3CH2CH2Br | B. | (CH3)3CCH2Br | C. | 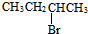 | D. | 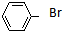 |
8.下列说法中正确的是( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 化学反应中1mol金属镁变成镁离子时得到电子数目为2NA | |
| C. | 有一种黄绿色气体,用湿润的淀粉KI试纸检测时,变蓝说明是氯气 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |