题目内容
16.亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:(一)鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释),NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示).
(2)沉淀法:取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两只试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10,则反应
AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{100}{9}$(计算结果写成分数).
(二)实验室可用如下装置(略去部分夹持仪器)制备亚硝酸钠.
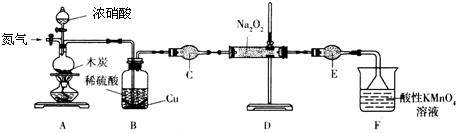
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置B的作用是吸收A中反应生成的二氧化氮气体,生成硝酸,与铜再反应生成一氧化氮气体,仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(3)装置F中酸性KMnO4溶液与NO发生反应的离子方程式为3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O.
分析 (一)(1)NaNO2溶液显示碱性,NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;根据亚硝酸钠溶液中的质子守恒分析;
(2)写出该反应的平衡常数表达式,然后根据Ksp(AgNO2)、Ksp(AgCl)进行计算;
(二)由制备亚硝酸钠的实验装置可知,先通入氮气,将装置中的空气排出,C与浓硝酸反应生成二氧化氮、二氧化碳,B中可除去二氧化氮,C为球形干燥管,干燥NO气体,D中发生2NO+Na2O2=2NaNO2,F为尾气处理,以此来解答.
解答 解:(一)(1)由于亚硝酸钠溶液中存在水解平衡:NO2-+H2O?HNO2+OH-,所以亚硝酸钠溶液显示碱性;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+),
故答案为:NO2-+H2O?HNO2+OH-;c(OH-)-c(H+);
(2)反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{c(N{{O}_{2}}^{-})}{c(C{l}^{-})}$,根据Ksp(AgCl)=c(Cl-)•c(Ag+)、Ksp(AgNO2)=c(NO2-)•c(Ag+)可知,K=$\frac{c(N{{O}_{2}}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgN{O}_{2})}{Ksp(AgCl)}$=$\frac{2×1{0}^{-8}}{1.8×1{0}^{-10}}$=$\frac{100}{9}$,
故答案为:$\frac{100}{9}$;
(二)由制备亚硝酸钠的实验装置可知,先通入氮气,将装置中的空气排出,C与浓硝酸反应生成二氧化氮、二氧化碳,B中可除去二氧化氮,C为球形干燥管,干燥NO气体,D中发生2NO+Na2O2=2NaNO2,F为尾气处理,
(1)由上述分析可知,加热装置A前,先通一段时间N2,目的是排出装置中的空气,故答案为:排出装置中的空气;
(2)装置B的作用是吸收A中反应生成的二氧化氮气体,生成硝酸,与铜再反应生成一氧化氮气体,仪器C的名称为干燥管,其中盛放的药品为碱石灰,
故答案为:吸收A中反应生成的二氧化氮气体,生成硝酸,与铜再反应生成一氧化氮气体;干燥管; 碱石灰;
(3)装置F中酸性KMnO4溶液与NO发生反应的离子方程式为3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O,故答案为:3MnO4-+5NO+4H+=5NO3-+3Mn2++2H2O.
点评 本题考查物质的制备实验及物质鉴别,为高频考点,把握制备实验原理、实验装置作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识、反应原理与实验相结合的训练,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在羽毛球、网球等体育项目中做球拍的碳纤维材料是一种新型无机非金属材料 | |
| B. | 从海水中提取溴和镁都必须通过化学反应才能实现 | |
| C. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| D. | 用饱和NH4Cl溶液可除去铁表面的锈斑 |
| A. | 相同条件下,测得Na2CO3溶液的pH大于相同物质的量浓度的Na2SO3溶液,说明非金属性:C<S | |
| B. | 绝热容器中,向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| C. | 相同温度时,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| D. | 有HX和HY两种弱酸且酸性HX>HY,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有 c(X-)>c(Y-)>c(OH-)>c(H+) |
| A. | X的氢化物的沸点高于同族其他元素氢化物的沸点 | |
| B. | 阴离子还原性:X>W;阳离子氧化性:Z>Y | |
| C. | X与Y两种元素可形成含有共价键的离子化合物 | |
| D. | Z与W两种元素形成的化合物在水溶液中不能存在 |
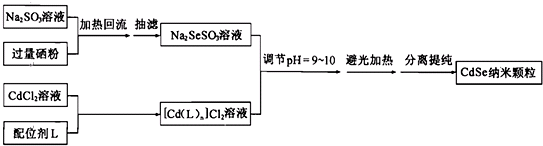
已知:①纳米颗粒通常指平均粒径为1~100nm的粒子
②CdSe纳米颗粒的大小影响会其发光性质.在一定配位剂浓度下,避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,结果如图1所示;某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图2所示:

则下列说法中正确的是( )
| A. | 在分离提纯CdSe时一般向溶液中加入丙酮,以增强溶剂极性,有利于CeSe的沉淀,提高收率 | |
| B. | 一般可用NaOH调节Na2SeSO3溶液的pH值,在此过程中会有HSe-和HSO3-生成 | |
| C. | 该纳米颗粒不能使用常压过滤或者减压过滤分离,因为其易在滤纸表面形成一层致密而厚实的膜,阻碍溶剂的通过 | |
| D. | 改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒;且若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 |
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | Na2CO3溶液中通入CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O |

 $\stackrel{NaNO_{2}}{→}$
$\stackrel{NaNO_{2}}{→}$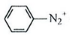


 .
. .D→E的反应类型是氧化反应.
.D→E的反应类型是氧化反应. )也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式
)也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式 (邻、间、对位置均可).
(邻、间、对位置均可). X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.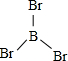 .
.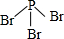 .
.