题目内容
下表列出了部分元素在周期表中的位置,按要求填空
(1)写出①、④、⑨、⑩的元素名称和元素符号
① ;④ ;⑨ ;⑩ ;
(2)写出②、⑧元素的原子结构示意图② ;⑧ ;
(3)写出③的氢化物的电子式 ;⑧和⑩形成的化合物的电子式 ;
(4)写出②的单质的结构式 ;
(5)①、②、③元素中原子半径最大的元素是 ,原子半径最小的是 ;⑤、⑥、⑧元素中金属性最强的是 ;⑦、⑩中原子得电子能力强的是 ;
(6)①、②的氢化物中稳定的是 ;⑧、⑨的最高价氧化物对应的水化物中碱性强的是 .(以上均填写元素符号或化学式)
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| 4 | ⑧ | ⑨ | ⑩ |
①
(2)写出②、⑧元素的原子结构示意图②
(3)写出③的氢化物的电子式
(4)写出②的单质的结构式
(5)①、②、③元素中原子半径最大的元素是
(6)①、②的氢化物中稳定的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素在周期表中位置,可知①为C、②为N、③为O、④为Ne、⑤为Na、⑥为Mg、⑦为Cl、⑧为K、⑨为Ca、⑩为Br;
(2)②为N元素,原子核外有7个电子,原子核外有2个电子层,各层电子数为2、5;
⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1;
(3)③的氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成;
(4)②的单质为N2,分子中N原子之间形成3对共用电子对;
(5)同周期自左而右原子半径减小;同周期自左而右金属性减弱,同主族自上而下金属性增强;同主族自上而下电负性减弱,得电子能力减弱;
(6)非金属性越强,氢化物越稳定;金属性越强,最高价氧化物对应水化物的碱性越强.
(2)②为N元素,原子核外有7个电子,原子核外有2个电子层,各层电子数为2、5;
⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1;
(3)③的氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成;
(4)②的单质为N2,分子中N原子之间形成3对共用电子对;
(5)同周期自左而右原子半径减小;同周期自左而右金属性减弱,同主族自上而下金属性增强;同主族自上而下电负性减弱,得电子能力减弱;
(6)非金属性越强,氢化物越稳定;金属性越强,最高价氧化物对应水化物的碱性越强.
解答:
解:(1)由元素在周期表中位置,可知①为C、②为N、③为O、④为Ne、⑤为Na、⑥为Mg、⑦为Cl、⑧为K、⑨为Ca、⑩为Br,故答案为:C;Ne;Ca;Br;
(2)②为N元素,原子核外有7个电子,原子核外有2个电子层,各层电子数为2、5,原子结构示意图为: ;⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1,原子结构示意图为:
;⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1,原子结构示意图为: ,故答案为:
,故答案为: ;
; ;
;
(3)③的氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对,其电子式为: ;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成,其电子式为:
;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成,其电子式为: ,
,
故答案为: ;
; ;
;
(4)②的单质为N2,分子中N原子之间形成3对共用电子对,结构式为N≡N,故答案为:N≡N;
(5)同周期自左而右原子半径减小,故原子半径:C>N>O;同周期自左而右金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Mg;同主族自上而下电负性减弱,得电子能力减弱,故得电子能力Cl>Br,故答案为:C;O;K;Cl;
(6)同周期自左而右非金属性减弱,故非金属性N>C,非金属性越强,氢化物越稳定,故氢化物稳定性NH3>CH4;同周期自左而右金属性减弱,故金属性K>Ca,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:KOH>Ca(OH)2,故答案为:NH3;KOH.
(2)②为N元素,原子核外有7个电子,原子核外有2个电子层,各层电子数为2、5,原子结构示意图为:
 ;⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1,原子结构示意图为:
;⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1,原子结构示意图为: ,故答案为:
,故答案为: ;
; ;
;(3)③的氢化物为H2O,分子中O原子与H原子之间形成1对共用电子对,其电子式为:
 ;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成,其电子式为:
;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成,其电子式为: ,
,故答案为:
 ;
; ;
;(4)②的单质为N2,分子中N原子之间形成3对共用电子对,结构式为N≡N,故答案为:N≡N;
(5)同周期自左而右原子半径减小,故原子半径:C>N>O;同周期自左而右金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Mg;同主族自上而下电负性减弱,得电子能力减弱,故得电子能力Cl>Br,故答案为:C;O;K;Cl;
(6)同周期自左而右非金属性减弱,故非金属性N>C,非金属性越强,氢化物越稳定,故氢化物稳定性NH3>CH4;同周期自左而右金属性减弱,故金属性K>Ca,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:KOH>Ca(OH)2,故答案为:NH3;KOH.
点评:本题考查元素周期表与元素周期表,侧重对元素周期律的考查,难度不大,注意理解掌握元素周期律.

练习册系列答案
相关题目
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A、2.7g金属铝变为铝离子时失去的电子数为0.3NA |
| B、1mol HCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数相等 |
| C、在标准状况下,22.4L CH4与18g H2O所含有电子不等 |
| D、22.4L的CO气体与1mol N2所含的电子数相等 |
化学与科技,社会,生产,生活等关系密切,下列说法错误的是( )
| A、乙烯的产量是衡量一个国家石油发展水平的标志 |
| B、减少燃煤的使用可以减少有毒有害气体对环境的污染 |
| C、将废弃塑料制品用化学方法加工成防水涂料或汽油 |
| D、35%--60%甲醛溶液俗称为福尔马林,具有很好的防腐杀菌效果,可用来浸泡海产品来起到保鲜效果 |
下列溶液中各离子的浓度由大到小排列顺序正确的是( )
| A、CH3COONa溶液中 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、NaHS溶液中:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+) |
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
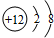 ,该离子的符号为
,该离子的符号为