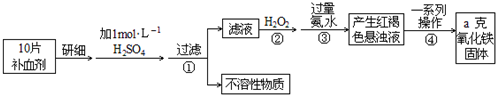
题目内容
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:(1)④、⑤、⑥的原子半径由大到小的顺序是
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)写出由④、⑤、⑧元素形成的可做消毒剂的一种化合物的化学式:
(4)用电子式表示④、⑤形成简单化合物的过程
(5)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
考点:元素周期律和元素周期表的综合应用,无机物的推断
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(3)④、⑤、⑧元素形成的可做消毒剂的一种化合物为次氯酸钠;②④形成的稳定化合物为CO2;
(4)④、⑤形成简单化合物为Na2O,由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成;
(5)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢分解为水与氧气;
(6)M为仅含非金属元素的盐,为铵盐,Z加热得到N,N可以得到Al,可推知Z为氢氧化铝、N为氧化铝,X、Y反应是铝盐和一水合氨的反应.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(3)④、⑤、⑧元素形成的可做消毒剂的一种化合物为次氯酸钠;②④形成的稳定化合物为CO2;
(4)④、⑤形成简单化合物为Na2O,由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成;
(5)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢分解为水与氧气;
(6)M为仅含非金属元素的盐,为铵盐,Z加热得到N,N可以得到Al,可推知Z为氢氧化铝、N为氧化铝,X、Y反应是铝盐和一水合氨的反应.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)④、⑤、⑧元素形成的可做消毒剂的一种化合物为次氯酸钠,化学式为NaClO;②④形成的稳定化合物为CO2,其电子式为: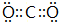 ,故答案为:NaClO;
,故答案为:NaClO;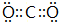 ;
;
(4)④、⑤形成简单化合物为Na2O,由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成为: ,
,
故答案为: ;
;
(5)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢分解为水与氧气,二氧化锰及氯化铁可以是过氧化氢分解的催化剂,过氧化氢具有强氧化性,可以氧化亚硫酸钠,酸性高锰酸钾具有强氧化性,可以氧化过氧化氢,
故答案为:ab;
(6)M为仅含非金属元素的盐,为铵盐,Z加热得到N,N可以得到Al,可推知Z为氢氧化铝、N为氧化铝,
知X、Y反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,M中阳离子为铵根离子,检验铵根离子方法为:取样品于试管中,加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,说明含有NH4+,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;取样品于试管中,加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,说明含有NH4+.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)④、⑤、⑧元素形成的可做消毒剂的一种化合物为次氯酸钠,化学式为NaClO;②④形成的稳定化合物为CO2,其电子式为:
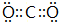 ,故答案为:NaClO;
,故答案为:NaClO;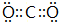 ;
;(4)④、⑤形成简单化合物为Na2O,由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成为:
 ,
,故答案为:
 ;
;(5)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,应是过氧化氢分解为水与氧气,二氧化锰及氯化铁可以是过氧化氢分解的催化剂,过氧化氢具有强氧化性,可以氧化亚硫酸钠,酸性高锰酸钾具有强氧化性,可以氧化过氧化氢,
故答案为:ab;
(6)M为仅含非金属元素的盐,为铵盐,Z加热得到N,N可以得到Al,可推知Z为氢氧化铝、N为氧化铝,
知X、Y反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,M中阳离子为铵根离子,检验铵根离子方法为:取样品于试管中,加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,说明含有NH4+,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;取样品于试管中,加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,说明含有NH4+.
点评:本题考查了元素周期表与元素周期律、无机物推断、常用化学应用、离子检验等,难度中等,注意掌握用电子式表示物质或化学键形成.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
我们的生活离不开能源,下列属于绿色能源的是( )
| A、天然气 | B、太阳能 | C、石油 | D、煤 |
关于Ba2++SO42-═BaSO4↓的反应说法正确的是( )
| A、只表示氯化钡与硫酸铜的反应 |
| B、表示氢氧化钡与硫酸铜的反应 |
| C、表示可溶性钡盐与可溶性硫酸盐溶液这一类型的反应 |
| D、只表示可溶性钡盐与可溶性硫酸盐的反应 |