题目内容
(1)常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是 .(填选项)
A.pH=4的醋酸 B.pH=10的NaOH溶液 C.pH=9的Na2CO3溶液 D.pH=2的硫酸 E.pH=4的NH4Cl溶液
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则在该温度下,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH= .(混合时溶液体积变化忽略不计)
(3)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应
①两溶液中由水电离出的H+浓度之比为
②若a=b,则反应后溶液中离子浓度从大到小的顺序是
(4)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
10.0g铁矿石
滤液A
溶液B
取20.00mL B的稀溶液
消耗KI溶液VmL
ⅰ、步骤④中煮沸的作用是 .
ⅱ、步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 .
ⅲ、下列有关步骤⑥的操作中说法正确的是 .
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
ⅳ、若滴定过程中消耗0.4000mol?L-1KI溶液25.00ml,则铁矿石中铁的百分含量为 .
A.pH=4的醋酸 B.pH=10的NaOH溶液 C.pH=9的Na2CO3溶液 D.pH=2的硫酸 E.pH=4的NH4Cl溶液
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则在该温度下,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH=
(3)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应
①两溶液中由水电离出的H+浓度之比为
②若a=b,则反应后溶液中离子浓度从大到小的顺序是
(4)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
10.0g铁矿石
| ①足量稀硫酸 |
| ②过滤 |
| ③通入足量Cl2 |
| ④加热煮沸 |
| ⑤稀释至250mL |
| ⑥用0.4000mol?L-1 |
| 的KI溶液滴定 |
ⅰ、步骤④中煮沸的作用是
ⅱ、步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
ⅲ、下列有关步骤⑥的操作中说法正确的是
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
ⅳ、若滴定过程中消耗0.4000mol?L-1KI溶液25.00ml,则铁矿石中铁的百分含量为
考点:离子积常数,pH的简单计算,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题,电离平衡与溶液的pH专题
分析:(1)常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,说明水的电离受抑制,酸或碱,而氢离子与氢氧根离子浓度之积为1×10-14;
(2)根据混合溶液的酸碱性计算氢离子浓度,从而计算溶液的pH;
(3)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应
①常温下,a mL pH=3的盐酸与b mL pH=11的氨水溶液,两溶液中由水电离出的H+浓度均为10-11mol/L;
②若a=b,两者恰好完全反应生成氯化铵和氨水,以氨气的电离为主,溶液呈碱性;
(4)ⅰ煮沸可以将水中的气体赶跑;
ⅱ、根据稀释液体和配制一定体积的溶液所选择的仪器来回答;
ⅲ、根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
ⅳ、根据元素守恒和化学反应方程式进行计算.
(2)根据混合溶液的酸碱性计算氢离子浓度,从而计算溶液的pH;
(3)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应
①常温下,a mL pH=3的盐酸与b mL pH=11的氨水溶液,两溶液中由水电离出的H+浓度均为10-11mol/L;
②若a=b,两者恰好完全反应生成氯化铵和氨水,以氨气的电离为主,溶液呈碱性;
(4)ⅰ煮沸可以将水中的气体赶跑;
ⅱ、根据稀释液体和配制一定体积的溶液所选择的仪器来回答;
ⅲ、根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
ⅳ、根据元素守恒和化学反应方程式进行计算.
解答:
解:(1)常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,说明水的电离受抑制,酸或碱,而氢离子与氢氧根离子浓度之积为1×10-14,而pH=2的硫酸溶液中氢离子与氢氧根离子浓度之积为1×10-12,故选:AB;
(2)酸中氢离子的物质的量=0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量=0.4mol/L×0.1L=0.04mol/L,混合溶液中氢氧根离子浓度=
=0.1mol/L,溶液中氢离子浓度为10-11mol/L,则溶液的pH=11,
故答案为:11;
(3)①常温下,a mL pH=3的盐酸与b mL pH=11的氨水溶液,两溶液中由水电离出的H+浓度均为10-11mol/L,则由水电离出的H+浓度之比为1:1,故答案为:1:1;
②若a=b,两者恰好完全反应生成氯化铵和氨水,以氨气的电离为主,溶液呈碱性,离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)ⅰ、向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl2,故答案为:赶走溶液中溶解的过量的Cl2;
ⅱ、容量瓶是一种定容仪器,若是稀释到250mL,则采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
ⅲ、a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故选df;
ⅳ、由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
×100%=70%,故答案为:70%.
(2)酸中氢离子的物质的量=0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量=0.4mol/L×0.1L=0.04mol/L,混合溶液中氢氧根离子浓度=
| 0.04mol-0.02mol |
| 0.2L |
故答案为:11;
(3)①常温下,a mL pH=3的盐酸与b mL pH=11的氨水溶液,两溶液中由水电离出的H+浓度均为10-11mol/L,则由水电离出的H+浓度之比为1:1,故答案为:1:1;
②若a=b,两者恰好完全反应生成氯化铵和氨水,以氨气的电离为主,溶液呈碱性,离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)ⅰ、向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl2,故答案为:赶走溶液中溶解的过量的Cl2;
ⅱ、容量瓶是一种定容仪器,若是稀释到250mL,则采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
ⅲ、a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故选df;
ⅳ、由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
| 0.5mol/L×0.25L×56g/mol |
| 10g |
点评:本题是考查了离子积常数的有关计算,一道探究物质的组成、测量物质的含量知识的一道综合考查题,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
去年年末,今年年初我国多省市遭遇雾霾笼罩,“PM2.5”数据监测纳入公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中,错误的是( )
| A、雾霾有可能产生丁达尔现象 |
| B、城市由于汽车尾气的大量排放,比农村形成雾霾天气的可能性更大 |
| C、氟利昂作制冷剂会加剧雾霾天气的形成 |
| D、雾霾天气严重危害人体健康 |
下列物质中,属于同素异形体的是( )
| A、O2 和 O3 |
| B、CO 和 CO2 |
| C、12C 和 13C |
| D、CH4 和 C2H6 |
下列说法正确的是( )
| A、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c (Mg2+)?c (CO32-)=6.82×10-6 |
| B、常温下,在0.10 mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,c( NH4+)/c(NH3?H2O)值变大 |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c (H2CO3) |
D、 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. |
下列分子中所有原子都满足最外层为8电子结构的是( )
| A、CCl4 |
| B、NO2 |
| C、PCl5 |
| D、NH3 |
下列粒子中,电子排布式为1s22s22p63s23p6的有( )
| A、Sc3+ |
| B、Mg2+ |
| C、Cl- |
| D、Br- |
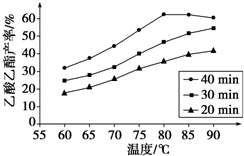 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: 化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:
化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题: